






人教版 (新课标)选修5 有机化学基础第二节 醛课堂教学课件ppt
展开1.了解乙醛的物理性质和用途。2.掌握乙醛与氢气的加成反应,乙醛的氧化反应。3.了解醛类的一般通性;常识性了解甲醛的性质和用途。4.能结合生产、生活实际了解醛类对环境和健康可能产生的影响,讨论它们的安全使用,关注它们对环境和健康的影响。
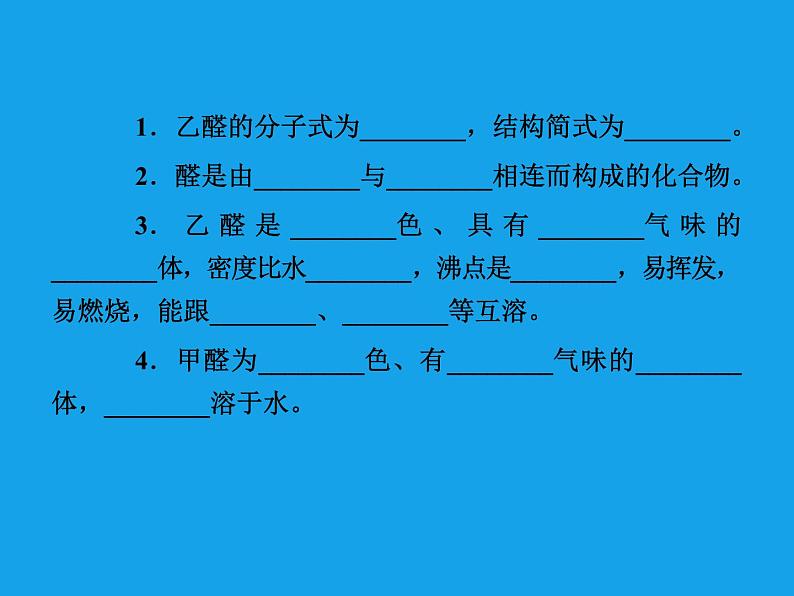
1.乙醛的分子式为________,结构简式为________。2.醛是由________与________相连而构成的化合物。3.乙醛是________色、具有________气味的________体,密度比水________,沸点是________,易挥发,易燃烧,能跟________、________等互溶。4.甲醛为________色、有________气味的________体,________溶于水。
5.写出下列反应的化学方程式:(1)乙醛发生银镜反应:____________。(2)乙醛与新制的Cu(OH)2悬浊液反应:____________。(3)乙醛在一定温度和催化剂存在的条件下被空气中的氧气氧化成乙酸:______________________________。(4)乙醛与氢气反应:_____________。
6.甲醛的分子式为________,电子式为________,结构式为________,结构简式为________。7.甲醛的化学性质与乙醛________,能发生________反应和________反应。8.甲醛是一种重要的有机合成原料,能合成多种有机化合物;它的水溶液(又称福尔马林)有________、________性能等。
【答案】 1.C2H4O CH3CHO2.烃基 醛基3.无 刺激性 液 小 20.8℃ 水 乙醇4.无 刺激性 气 易
7.相似 氧化 加成8.杀菌 防腐
1.乙醛与氢气的加成反应,也可说乙醛发生还原反应,为什么?提示:在无机化学中是通过化合价的变化,或者说是通过电子的得失来判断氧化还原反应的。而在有机化学中是以组成中氢原子或氧原子数目的变化来判断氧化还原反应。加氧去氢为氧化,去氧加氢为还原。在乙醛与氢气加成转变为乙醇的反应中,乙醛中羰基的碳氧双键断开,每个原子上各连接一个氢原子,属于加氢反应,也属于还原反应。
2.结合乙醛的结构,说明乙醛的氧化反应和还原反应有什么特点。提示:结合乙醛的结构特点,从得失氧或得失氢的角度,分析分子中哪些部位易发生反应。乙醛能被氧化生成乙酸,也能被还原生成乙醇,说明乙醛既有还原性,又有氧化性。根据乙醛发生氧化、还原反应的条件可以确定,乙醛的还原性强而氧化性弱。乙醛发生氧化反应生成乙酸,属于加氧氧化,乙醛发生还原反应生成乙醇,属于加氢还原。
1.醛的概念分子里由烃基与醛基(—CHO)相连而构成的化合物叫做醛。说明:(1)醛基要写成—CHO,而不能写成—COH。(2)醛一定含有醛基,但含有醛基的物质不一定是醛(如后面要学习到的甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等都含有醛基),但它们都具有醛基的化学性质。
2.醛的分类(1)按醛基数目分
(2)按烃基饱和程度分
3.醛的通式有机物分子里每有一个醛基的存在,就使碳原子上少两个氢原子。因此,若烃CnHm衍变为x元醛,该醛的分子式为CnH(m-2x)Ox。饱和一元醛的通式为CnH2nO(n=1,2,3…)。
4.醛的命名醛的命名和醇的命名相似,下面是一些常见的结构简式和名称。
【例1】 甲醛、乙醛、丙醛组成的混合物中,氢元素的质量分数为9%,则氧元素的质量分数是( )A.37% B.16%C.6% D.26%【解析】 醛的通式为CnH2nO,从通式可知:N(C)∶N(H)=1∶2,m(C)∶m(H)=6∶1,所以w(O)=1-9%-9%×6=37%。【答案】 A
已知甲醛(HCHO)分子中的4个原子是共平面的。下列分子中所有原子不可能同时存在于同一个平面上的是( )
【解析】 已知甲醛的4个原子是共平面的, 提示了羰基的碳原子所连接的3个原子也是共平面的。因此,苯环(本身是共平面的一个环)有可能代替乙烯的1个H。OH也有可能代替甲醛的1个H,B、C都可能在一个平面上。乙烯的6个原子是共平面的,苯环代替了1个H,可以共平面。只有苯乙酮,由于—CH3的C位于四面体的中心,3个H和羰基的C位于四面体的顶点,不可能共平面。【答案】 D
下列物质不属于醛类的是( )
一、乙醛的分子组成与结构分子式:C2H4O
二、乙醛的物理性质1.色、态、味:无色、具有刺激性气味的液体。2.溶解性:能与水、乙醇、乙醚、氯仿等溶剂互溶。3.沸点:20.8°C,接近室温,故极易挥发。
三、乙醛的化学性质1.乙醛的加成反应乙醛分子中的碳氧双键能够发生加成反应。例如,使乙醛蒸气和氢气的混合气体通过热的镍催化剂,乙醛与氢气即发生加成反应:
说明:在有机化学反应中,通常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应。乙醛与氢气的加成反应就属于还原反应。同理,有机物分子中失去氢原子或加入氧原子的反应叫做氧化反应。
(3)被弱氧化剂氧化的反应①乙醛被银氨溶液氧化a.银氨溶液配制的反应原理:AgNO3+NH3·H2O===AgOH↓(白色)+NH4NO3AgOH+2NH3·H2O===Ag(NH3)2OH+2H2O
注意:配制银氨溶液时,应防止加入过量的氨水,并且必须随配随用,不可久置,否则会生成容易爆炸的物质,该物质是Ag3N,这种物质哪怕是用玻璃棒刮擦也会分解而发生强烈的爆炸。
注意:实验中所用的Cu(OH)2必须是新制的。制取Cu(OH)2是在NaOH溶液中滴入少量的CuSO4溶液,NaOH要过量。
【例2】 下列有关银镜反应的实验,说法正确的是( )A.试管先用热烧碱溶液洗涤,然后再用蒸馏水洗涤B.向2%的稀氨水中滴加2%的硝酸银溶液,配得银氨溶液C.可采用水浴加热,也可直接加热D.可用浓盐酸洗去银镜
【解析】 银镜反应实验成功与否和试管是否洁净有很大关系。先用碱液洗涤试管,主要是除去油垢,A项说法正确;配制银氨溶液,是将2%的稀氨水逐滴滴加到2%的AgNO3溶液中,且边滴加边振荡,直到最初的沉淀恰好完全溶解为止,B项说法错误;银镜反应实验一定是水浴加热,C项说法错误;盐酸不能洗去银镜,应用稀硝酸洗涤,D项说法错误。故选A。【答案】 A
【例3】 某一元醛发生银镜反应可得21.6g 银,将等量的醛完全燃烧,生成3.6g H2O,此醛可能为( )A.乙醛 B.丙醛C.丁醛 D.戊醛【解析】 由关系式R—CHO~2Ag可求出参加反应的醛的物质的量为0.1ml,而0.1ml 该醛完全燃烧生成3.6g 水,据此可推出一个该醛分子中应含有4个氢原子。故选A。【答案】 A
下列实验能获得成功的是( )A.将乙醛滴入银氨溶液中,加热煮沸制银镜B.苯与浓溴水反应制取溴苯C.向浓溴水中加几滴苯酚,观察到有白色沉淀生成D.1ml/L CuSO4溶液2mL和0.5ml/L NaOH溶液4mL 混合后加入40%的乙醛溶液0.5mL,加热煮沸,观察沉淀的颜色
【解析】 本题考查的是乙醛、苯、苯酚的性质。A选项中需用水浴加热才能生成银镜;B选项中苯与溴的取代反应必须是苯与液溴,溴水是不能发生反应的,只会发生萃取;D选项中NaOH明显不足,不能得到红色沉淀。【答案】 C
某醛的结构简式为(CH3)2CCHCH2CH2CHO。(1)检验分子中醛基的方法是________,化学反应方程式为________。(2)检验分子中碳碳双键的方法是________,化学反应方程式为________。(3)实验操作中,哪一个官能团应先检验?________。
(3)由于Br2也能氧化—CHO,所以必须先用银氨溶液氧化醛基,又因为氧化后溶液为碱性,所以应先加酸酸化后再加溴水检验碳碳双键。
1.甲醛的物理性质及应用甲醛也叫蚁醛。在通常状况下甲醛是一种无色具有强烈刺激性气味的气体,易溶于水。质量分数为35%~40%的甲醛水溶液叫做福尔马林。
甲醛是一种重要的有机原料,应用于塑料工业(如制酚醛树脂)、合成纤维工业、制革工业等,甲醛的水溶液具有杀菌和防腐能力,是一种良好的杀菌剂,在农业上常用稀释的福尔马林溶液(质量分数为0.1%~0.5%)来浸种,给种子消毒,福尔马林还用来浸制生物标本。此外,甲醛还是制氯霉素、香料、染料的原料。说明:(1)甲醛是典型的气态(通常状况下)醛。(2)甲醛有毒,易燃烧,在使用甲醛或与甲醛有关的物质时,要注意安全及环境保护。
说明:从分子结构上看,甲醛是最简单的醛,通常把它归为饱和一元醛。但在与弱氧化剂的反应中,1ml HCHO最多可还原出4ml 的Ag或2ml 的Cu2O,这是因为同物质的量的甲醛是乙醛等其他一元醛还原能力的两倍,故甲醛又像二元醛。
4.酮(1)定义:羰基(CO)与两个烃基相连的化合物叫酮(R′COR)。饱和一元酮的通式为CnH2nO(n≥3),它与相同碳原子数的醛互为同分异构体。(2)丙酮。常温下,丙酮是无色透明的液体,易挥发,与水、乙醇互溶,不能被银氨溶液、新制Cu(OH)2等弱氧化剂氧化,但可催化加氢生成醇。丙酮是一种重要的有机溶剂和化工原料。
【例5】 某饱和一元醇和饱和一元醛的混合物共3g,跟足量的银氨溶液完全反应后,可还原出16.2g银,下列说法中正确的是( )A.此醛一定是甲醛B.此醛可能是乙醛C.混合物中二者的质量比是1∶3D.不可能有此种醛
【解析】 本题考查了有机化学反应方程式的计算,通过计算判断物质的种类,特别注重考查甲醛的特殊结构。
下列物质可用于消毒、杀菌的是( )①苯酚 ②高锰酸钾 ③福尔马林 ④双氧水 ⑤次氯酸A.只有①③⑤ B.只有②④⑤C.只有①②④ D.全部
【解析】 本题考查的是一些常见物质的性质。苯酚可用于环境消毒;福尔马林是甲醛溶液,有杀菌、防腐性能,常用于浸制生物标本;高锰酸钾、次氯酸及双氧水有强氧化性,可用于消毒、杀菌。故正确答案为D。【答案】 D
根据柠檬醛的结构简式:
【解析】 由柠檬醛分子中含有CC和—CHO知,A、B、C叙述是正确的,D是错误的,故选D。【答案】 D
1.醛基的检验(1)银镜反应醛类具有较强的还原性,能和银氨溶液反应,被氧化为羧酸,同时得到单质银,若控制好反应条件,可以得到光亮的银镜。因此实验时应注意以下几点:①试管内壁必须光滑、洁净;②应使用水浴加热;③加热过程中不可振荡和振动试管;④实验的银氨溶液应现配现用;⑤醛的用量不宜太多;⑥实验后附着银镜的试管可用稀硝酸浸泡,再用水洗而除去。
(2)与新制的Cu(OH)2反应醛类可在加热条件下与新制的Cu(OH)2反应,醛被氧化为羧酸,同时Cu(OH)2被还原成砖红色的Cu2O沉淀,这是检验醛基的又一种方法。实验时应注意以下几点:①硫酸铜与碱反应制取Cu(OH)2时碱应过量;②混合液必须加热到沸腾时才会有砖红色沉淀生成。
2.能使溴水和酸性KMnO4溶液褪色的有机物(1)能使溴水褪色的有机物①跟烯烃、炔烃、二烯烃等不饱和烃发生加成反应而使溴水褪色;②跟含醛基的有机物发生氧化还原反应而使溴水褪色;③跟苯酚等有机物发生取代反应而使溴水褪色;④汽油、苯和苯的同系物、四氯化碳、己烷、氯仿等与溴水混合时,能通过萃取使溴水中的溴进入有机溶剂层而使水层褪色,但这是物理变化。
(2)能使酸性KMnO4溶液褪色的有机物①分子中含CC键或CC键的不饱和有机物,都能被酸性KMnO4溶液氧化而使其褪色。②苯环上的侧链也能使酸性KMnO4溶液褪色。③含有醇羟基、酚羟基、醛基等的有机物,一般能被酸性KMnO4溶液氧化而使其褪色。
【例6】 某学生用2mL 1ml/L的CuSO4溶液和4mL 0.5ml/L的NaOH溶液混合,然后加入0.5mL 4%的HCHO溶液,加热到沸腾,未见红色沉淀,失败的主要原因是( )A.甲醛量太少 B.硫酸铜量太少C.NaOH量太少 D.加热时间短【解析】 因n(CuSO4)∶n(NaOH)=1∶1,表明CuSO4过量,碱不足,而醛与新制Cu(OH)2反应时必须碱过量。故选C。【答案】 C
丙烯醛的结构简式为CH2CHCHO。下列关于它性质的叙述中错误的是( )A.能使溴水褪色,也能使高锰酸钾酸性溶液褪色B.在一定条件下与H2充分反应,生成1-丙醇C.能发生银镜反应表现出氧化性D.在一定条件下能被空气氧化
高中化学第二节 醛授课课件ppt: 这是一份高中化学第二节 醛授课课件ppt,共39页。PPT课件主要包含了第二节醛,醛的定义,醛的分类,化学性质等内容,欢迎下载使用。
化学选修5 有机化学基础第五章 进入合成高分子化合物的时代综合与测试复习课件ppt: 这是一份化学选修5 有机化学基础第五章 进入合成高分子化合物的时代综合与测试复习课件ppt,共32页。PPT课件主要包含了答案A等内容,欢迎下载使用。
高中化学人教版 (新课标)选修5 有机化学基础第一节 油脂背景图课件ppt: 这是一份高中化学人教版 (新课标)选修5 有机化学基础第一节 油脂背景图课件ppt,共54页。PPT课件主要包含了答案C等内容,欢迎下载使用。













