




还剩30页未读,
继续阅读
高中化学苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用教课ppt课件
展开
这是一份高中化学苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用教课ppt课件,共38页。PPT课件主要包含了2熔化,①②④,⑤⑥⑦⑨⑩,③⑤⑥⑦⑨⑩,离子键,③①②,共价键,NH3,分子间作用力,NH3分子之间能形等内容,欢迎下载使用。
1.掌握化学键、分子间作用力、氢键的含义及区别,了解其对物质性质的影响,培养证据推理与模型认知的化学核心素养。2.掌握物质溶解、熔化及化学反应过程中作用力的破坏与形成,提升变化观念与平衡思想的学科核心素养。
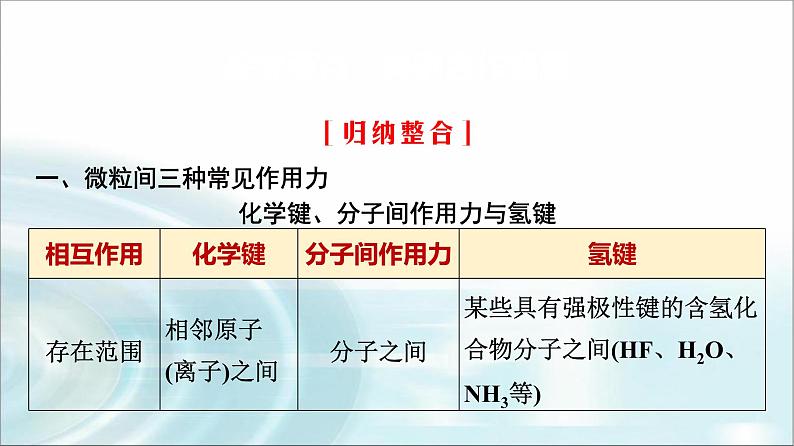
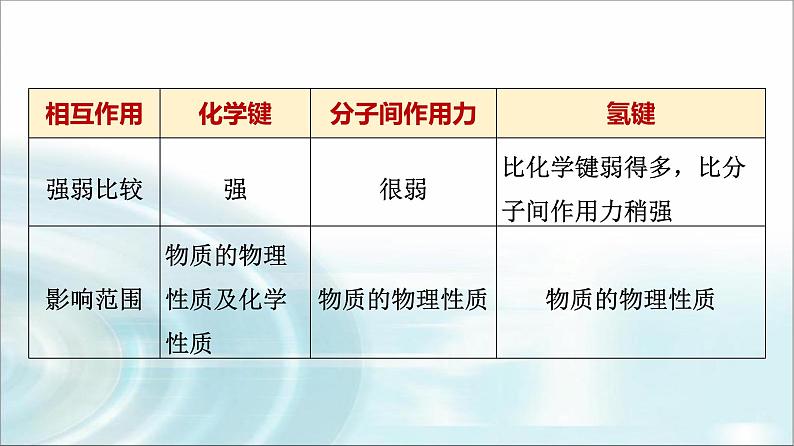
一、微粒间三种常见作用力化学键、分子间作用力与氢键
探究要点 典例合作细解
3.化学反应一定伴随化学键的变化,而化学键变化不一定发生化学反应。
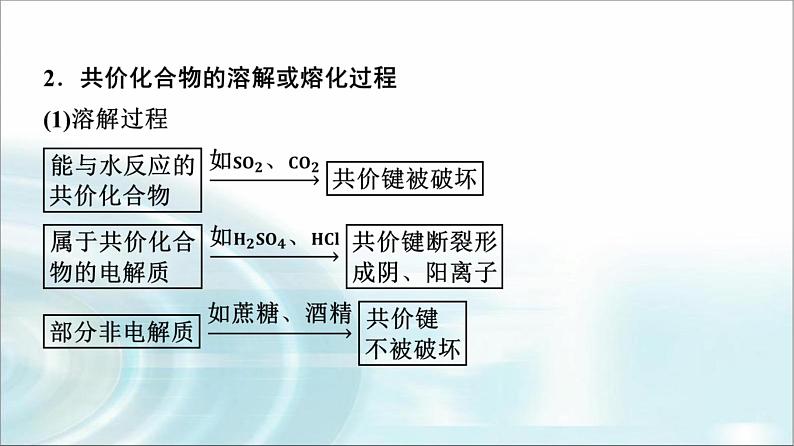
现有以下物质:①O2;②金刚石;③NaBr;④H2SO4;⑤Na2CO3;⑥NH4Cl;⑦NaHSO4;⑧Ne;⑨Na2O2;⑩NaOH。(1)这些物质中,只含共价键的是________(填序号,下同);只含离子键的是______;既含共价键又含离子键的是____________;不存在化学键的是______。
(2)属于共价化合物的是______(填序号,下同);属于离子化合物的是__________________。(3)将NaHSO4溶于水,破坏了NaHSO4中的_____________________,写出电离方程式:______________________________;NaHSO4熔融状态下电离,破坏了__________,写出电离方程式:______________________________。
离子键和(极性)共价键
1.下列各项顺序中正确且可以用分子间作用力大小解释的是( )A.稳定性:HF>HCl>H2SB.沸点:CF4CH3COOH>H2CO3D.熔点:MgO>NaCl>KCl
B [A项中分子的稳定性、D项中离子化合物的熔点高低分别由共价键、离子键的强弱决定,因为要使HX分解或MgO、NaCl、KCl等离子化合物熔化,必须破坏HX分子中的共价键、离子化合物中的离子键;C项中的酸性与分子间作用力无关,只有B项中的沸点逐渐升高是分子间作用力逐渐增大(相对分子质量逐渐增大)的缘故。]
2.氢键是一种分子间作用力,普遍存在于N、O、F的原子与H原子之间,非金属性越强的原子与氢原子形成氢键越强。氢键可以表示为:“A-H…B-”,其中A、B表示N、F、O原子,“-”表示共价键,“…”表示氢键,根据你所学习氢键的知识,请分析下列问题:(1)在下列几种氢键:①O-H…O;②N-H…N;③F-H…F;则按氢键由强到弱的顺序是_____________(填序号)。
(2)H2O、H2S与H2Se的结构相似,则H2O、H2S与H2Se的沸点大小顺序为________________,其判断依据为______________________________________________________________________________。
H2O>H2Se>H2S
H2O中存在氢键,H2Se的相对分子质量大于H2S的,故沸点:H2O>H2Se>H2S
[解析] (1)非金属性越强的原子形成的氢键越强,所以三种氢键的强弱顺序为③>①>②。(2)H2O在汽化时需要破坏氢键和分子间作用力,所以沸点最高;H2Se的相对分子质量大于H2S的相对分子质量,其对应的H2Se的分子间作用力大于H2S的分子间作用力,所以H2Se的沸点大于H2S的沸点。
1.HF分子非常稳定,原因是( )A.分子间作用力很强 B.分子中含氢键C.HF含离子键 D.氢氟化学键很强
基本能力 随堂评估自测
2.CO2气体在一定条件下可与金属镁反应,干冰在一定条件下也可以形成CO2气体,这两个变化过程中需要克服的作用力分别是( )A.化学键,化学键B.化学键,分子间作用力C.分子间作用力,化学键D.分子间作用力,分子间作用力
B [CO2与金属镁反应是化学变化,反应过程中存在化学键的断裂和形成,故需要克服化学键,干冰形成CO2气体是状态之间的转化,仅需要克服分子间作用力。]
3.下列物质的变化过程中,有共价键明显被破坏的是( )A.从饮料酒中闻到了醇香味B.NaCl颗粒被粉碎C.H2SO4溶于水得硫酸溶液D.NaOH受热熔化
4.已知:N、P都属于ⅤA族的元素,NH3和PH3的分子结构相似,根据你所学的知识请回答下列问题:(1)PH3分子中的P原子和H原子以________(填化学键的类型)结合。(2)NH3分子和PH3分子比较,热稳定性好的是________,你判断的理由是________________________________________________________________________________________________________。
因N的非金属性比P的非金属性强,所以N的氢化物NH3分子比P的氢化物PH3分子稳定
(3)NH3和PH3在常温下都是气体,NH3比PH3的相对分子质量小,但固体NH3比固体PH3的熔、沸点高,原因是_________________________________________________________________________________________________________________________________。(4)PH4Cl应与NH4Cl一样,都属于盐,在PH4Cl中存在的作用力有__________________。
因NH3分子之间能形成氢键,所以NH3在汽化、液化时需要破坏氢键而PH3只需破坏分子间作用力
[解析] (1)PH3分子中的P原子和H原子以共价键结合。(2)若某物质受热不分解或很难分解,则该物质热稳定性好,对于NH3分子和PH3分子,因它们是同一主族元素N、P的氢化物,根据N、P的非金属性强弱得出,NH3分子的稳定性大于PH3分子的稳定性。(3)物质的熔、沸点高低主要取决于物质在熔化和汽化时破坏的作用力大小,因NH3分子间存在氢键和分子间作用力,而PH3分子间只存在分子间作用力,所以固体NH3比固体PH3的熔、沸点高。(4)PH4Cl应与NH4Cl一样,都属于盐,在PH4Cl中存在的作用力有离子键、共价键。
能力课时培优练(6) 微粒间作用力及物质变化
2.人们发现金星大气层有一种被称为羰基硫(COS)的分子,其结构与CO2相似,羰基硫是一种与生命密切相关的物质。下列推测肯定不正确的是( )A.COS是含有极性键的共价化合物B.COS的沸点比CO2高C.COS的电子式为D.COS中所有原子最外层都满足8电子稳定结构
C [COS是共价化合物,含有的C==O键和C==S键是极性键,A项正确;由于Mr(COS)>Mr(CO2),且COS的结构与CO2相似,则COS的沸点高于CO2,B项正确;COS相当于CO2分子中的一个氧原子被硫原子取代,电子式是 ,C项错误;COS中碳元素的化合价是+4价,氧元素和硫元素的化合价都是-2价,碳原子的原子核外最外层电子数为4,氧原子和硫原子的原子核外最外层电子数均为6,所以COS中所有原子均满足最外层8电子稳定结构,D项正确。]
3.下列说法正确的是( )A.随着卤素原子X的电子层数的增加,卤化物CX4分子间作用力逐渐增大,所以卤化物CX4的熔沸点也逐渐升高B.冰融化时,分子中H-O键发生断裂C.由于H-O键比H-S键牢固,所以水的熔沸点比H2S高D.在由分子所构成的物质中,分子间作用力越大,该物质越稳定
A [分子构成的结构和组成相似的物质,其熔沸点与相对分子质量有关,随着相对分子质量的增加,卤化物CX4分子间作用力逐渐增大,熔沸点逐渐升高,A正确;冰融化时发生物理变化,不破坏化学键,B错误;水的熔沸点比H2S高是因为水分子间存在氢键,C错误;物质的稳定性与化学键有关,与分子间作用力无关,D错误。]
4.下列物质与相应的作用方式组合正确的是( )
C [干冰是固态的二氧化碳,属于共价化合物,二氧化碳分子内存在的是碳原子与氧原子之间的共价键,二氧化碳分子间是通过分子间作用力结合的,A项错误;氯化钠是由简单的Na+和Cl-结合而成的离子化合物,只存在离子键,B项错误;氢氧化钠是由Na+和OH-结合而成的离子化合物,所以存在离子键,而OH-中的氢原子和氧原子之间通过共价键结合,C项正确;氩气是稀有气体,属于不含任何化学键的物质,分子与分子之间通过分子间作用力结合,D项错误。]
5.下列叙述与分子间作用力无关的是( )A.气体物质加压或降温时能凝结或凝固B.干冰易升华C.氟、氯、溴、碘单质的熔、沸点依次升高D.二氧化碳气体在加热条件下不易分解
D [A、B、C三项中涉及的物质都是分子,其原因依次是存在分子间作用力、分子间作用力很弱、(由F2→I2)分子间作用力逐渐增强,均与分子间作用力的大小有关系。D项,要使CO2发生分解必须破坏共价键,由于C==O键难断裂,所以CO2难分解,与分子间作用力无关。]
6.下列说法中正确的是( )A.CaO与水反应的过程中,有共价键的断裂和形成B.H2O的热稳定性比H2S的强,是由于H2O的分子间作用力较大C.KCl、HCl、KOH的水溶液都能导电,所以它们都属于离子化合物D.葡萄糖、二氧化碳和足球烯(C60)都是共价化合物
A [A项,CaO与H2O反应,有H2O中共价键的断裂和Ca(OH)2中共价键的形成,正确;B项,H2O的热稳定性比H2S的强是由于H-O键比H-S键牢固,与分子间作用力无关;C项,HCl属于共价化合物;D项,足球烯(C60)属于单质,不是共价化合物。]
7.a、b、c、d为四种短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
请回答下列问题:(1)将单质a降温加压时气体会液化,再降温时液体会凝固,说明在液体和固体单质a分子之间存在_____________,b分子极易被液化,常用作制冷剂,请分析b分子易被液化的原因为__________________________。(2)b、c分子在d中的溶解度相差非常大,其原因是_____________________________________________________________________。(3)在c分子中的电子式为__________。
分子之间能形成氢键,使NH3易溶于水
[解析] 分别写出含有10个电子的微粒(五核指的是含有5个原子,有5个原子核)。
1.掌握化学键、分子间作用力、氢键的含义及区别,了解其对物质性质的影响,培养证据推理与模型认知的化学核心素养。2.掌握物质溶解、熔化及化学反应过程中作用力的破坏与形成,提升变化观念与平衡思想的学科核心素养。
一、微粒间三种常见作用力化学键、分子间作用力与氢键
探究要点 典例合作细解
3.化学反应一定伴随化学键的变化,而化学键变化不一定发生化学反应。
现有以下物质:①O2;②金刚石;③NaBr;④H2SO4;⑤Na2CO3;⑥NH4Cl;⑦NaHSO4;⑧Ne;⑨Na2O2;⑩NaOH。(1)这些物质中,只含共价键的是________(填序号,下同);只含离子键的是______;既含共价键又含离子键的是____________;不存在化学键的是______。
(2)属于共价化合物的是______(填序号,下同);属于离子化合物的是__________________。(3)将NaHSO4溶于水,破坏了NaHSO4中的_____________________,写出电离方程式:______________________________;NaHSO4熔融状态下电离,破坏了__________,写出电离方程式:______________________________。
离子键和(极性)共价键
1.下列各项顺序中正确且可以用分子间作用力大小解释的是( )A.稳定性:HF>HCl>H2SB.沸点:CF4
B [A项中分子的稳定性、D项中离子化合物的熔点高低分别由共价键、离子键的强弱决定,因为要使HX分解或MgO、NaCl、KCl等离子化合物熔化,必须破坏HX分子中的共价键、离子化合物中的离子键;C项中的酸性与分子间作用力无关,只有B项中的沸点逐渐升高是分子间作用力逐渐增大(相对分子质量逐渐增大)的缘故。]
2.氢键是一种分子间作用力,普遍存在于N、O、F的原子与H原子之间,非金属性越强的原子与氢原子形成氢键越强。氢键可以表示为:“A-H…B-”,其中A、B表示N、F、O原子,“-”表示共价键,“…”表示氢键,根据你所学习氢键的知识,请分析下列问题:(1)在下列几种氢键:①O-H…O;②N-H…N;③F-H…F;则按氢键由强到弱的顺序是_____________(填序号)。
(2)H2O、H2S与H2Se的结构相似,则H2O、H2S与H2Se的沸点大小顺序为________________,其判断依据为______________________________________________________________________________。
H2O>H2Se>H2S
H2O中存在氢键,H2Se的相对分子质量大于H2S的,故沸点:H2O>H2Se>H2S
[解析] (1)非金属性越强的原子形成的氢键越强,所以三种氢键的强弱顺序为③>①>②。(2)H2O在汽化时需要破坏氢键和分子间作用力,所以沸点最高;H2Se的相对分子质量大于H2S的相对分子质量,其对应的H2Se的分子间作用力大于H2S的分子间作用力,所以H2Se的沸点大于H2S的沸点。
1.HF分子非常稳定,原因是( )A.分子间作用力很强 B.分子中含氢键C.HF含离子键 D.氢氟化学键很强
基本能力 随堂评估自测
2.CO2气体在一定条件下可与金属镁反应,干冰在一定条件下也可以形成CO2气体,这两个变化过程中需要克服的作用力分别是( )A.化学键,化学键B.化学键,分子间作用力C.分子间作用力,化学键D.分子间作用力,分子间作用力
B [CO2与金属镁反应是化学变化,反应过程中存在化学键的断裂和形成,故需要克服化学键,干冰形成CO2气体是状态之间的转化,仅需要克服分子间作用力。]
3.下列物质的变化过程中,有共价键明显被破坏的是( )A.从饮料酒中闻到了醇香味B.NaCl颗粒被粉碎C.H2SO4溶于水得硫酸溶液D.NaOH受热熔化
4.已知:N、P都属于ⅤA族的元素,NH3和PH3的分子结构相似,根据你所学的知识请回答下列问题:(1)PH3分子中的P原子和H原子以________(填化学键的类型)结合。(2)NH3分子和PH3分子比较,热稳定性好的是________,你判断的理由是________________________________________________________________________________________________________。
因N的非金属性比P的非金属性强,所以N的氢化物NH3分子比P的氢化物PH3分子稳定
(3)NH3和PH3在常温下都是气体,NH3比PH3的相对分子质量小,但固体NH3比固体PH3的熔、沸点高,原因是_________________________________________________________________________________________________________________________________。(4)PH4Cl应与NH4Cl一样,都属于盐,在PH4Cl中存在的作用力有__________________。
因NH3分子之间能形成氢键,所以NH3在汽化、液化时需要破坏氢键而PH3只需破坏分子间作用力
[解析] (1)PH3分子中的P原子和H原子以共价键结合。(2)若某物质受热不分解或很难分解,则该物质热稳定性好,对于NH3分子和PH3分子,因它们是同一主族元素N、P的氢化物,根据N、P的非金属性强弱得出,NH3分子的稳定性大于PH3分子的稳定性。(3)物质的熔、沸点高低主要取决于物质在熔化和汽化时破坏的作用力大小,因NH3分子间存在氢键和分子间作用力,而PH3分子间只存在分子间作用力,所以固体NH3比固体PH3的熔、沸点高。(4)PH4Cl应与NH4Cl一样,都属于盐,在PH4Cl中存在的作用力有离子键、共价键。
能力课时培优练(6) 微粒间作用力及物质变化
2.人们发现金星大气层有一种被称为羰基硫(COS)的分子,其结构与CO2相似,羰基硫是一种与生命密切相关的物质。下列推测肯定不正确的是( )A.COS是含有极性键的共价化合物B.COS的沸点比CO2高C.COS的电子式为D.COS中所有原子最外层都满足8电子稳定结构
C [COS是共价化合物,含有的C==O键和C==S键是极性键,A项正确;由于Mr(COS)>Mr(CO2),且COS的结构与CO2相似,则COS的沸点高于CO2,B项正确;COS相当于CO2分子中的一个氧原子被硫原子取代,电子式是 ,C项错误;COS中碳元素的化合价是+4价,氧元素和硫元素的化合价都是-2价,碳原子的原子核外最外层电子数为4,氧原子和硫原子的原子核外最外层电子数均为6,所以COS中所有原子均满足最外层8电子稳定结构,D项正确。]
3.下列说法正确的是( )A.随着卤素原子X的电子层数的增加,卤化物CX4分子间作用力逐渐增大,所以卤化物CX4的熔沸点也逐渐升高B.冰融化时,分子中H-O键发生断裂C.由于H-O键比H-S键牢固,所以水的熔沸点比H2S高D.在由分子所构成的物质中,分子间作用力越大,该物质越稳定
A [分子构成的结构和组成相似的物质,其熔沸点与相对分子质量有关,随着相对分子质量的增加,卤化物CX4分子间作用力逐渐增大,熔沸点逐渐升高,A正确;冰融化时发生物理变化,不破坏化学键,B错误;水的熔沸点比H2S高是因为水分子间存在氢键,C错误;物质的稳定性与化学键有关,与分子间作用力无关,D错误。]
4.下列物质与相应的作用方式组合正确的是( )
C [干冰是固态的二氧化碳,属于共价化合物,二氧化碳分子内存在的是碳原子与氧原子之间的共价键,二氧化碳分子间是通过分子间作用力结合的,A项错误;氯化钠是由简单的Na+和Cl-结合而成的离子化合物,只存在离子键,B项错误;氢氧化钠是由Na+和OH-结合而成的离子化合物,所以存在离子键,而OH-中的氢原子和氧原子之间通过共价键结合,C项正确;氩气是稀有气体,属于不含任何化学键的物质,分子与分子之间通过分子间作用力结合,D项错误。]
5.下列叙述与分子间作用力无关的是( )A.气体物质加压或降温时能凝结或凝固B.干冰易升华C.氟、氯、溴、碘单质的熔、沸点依次升高D.二氧化碳气体在加热条件下不易分解
D [A、B、C三项中涉及的物质都是分子,其原因依次是存在分子间作用力、分子间作用力很弱、(由F2→I2)分子间作用力逐渐增强,均与分子间作用力的大小有关系。D项,要使CO2发生分解必须破坏共价键,由于C==O键难断裂,所以CO2难分解,与分子间作用力无关。]
6.下列说法中正确的是( )A.CaO与水反应的过程中,有共价键的断裂和形成B.H2O的热稳定性比H2S的强,是由于H2O的分子间作用力较大C.KCl、HCl、KOH的水溶液都能导电,所以它们都属于离子化合物D.葡萄糖、二氧化碳和足球烯(C60)都是共价化合物
A [A项,CaO与H2O反应,有H2O中共价键的断裂和Ca(OH)2中共价键的形成,正确;B项,H2O的热稳定性比H2S的强是由于H-O键比H-S键牢固,与分子间作用力无关;C项,HCl属于共价化合物;D项,足球烯(C60)属于单质,不是共价化合物。]
7.a、b、c、d为四种短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
请回答下列问题:(1)将单质a降温加压时气体会液化,再降温时液体会凝固,说明在液体和固体单质a分子之间存在_____________,b分子极易被液化,常用作制冷剂,请分析b分子易被液化的原因为__________________________。(2)b、c分子在d中的溶解度相差非常大,其原因是_____________________________________________________________________。(3)在c分子中的电子式为__________。
分子之间能形成氢键,使NH3易溶于水
[解析] 分别写出含有10个电子的微粒(五核指的是含有5个原子,有5个原子核)。













