

苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用完美版课件ppt
展开1.了解共价键的概念及其形成,了解共价化合物的概念。2.了解有机化合物中碳原子的成键特点和成键方式。3.学会用电子式表示共价键以及共价分子;会用结构式表示共价键以及共价分子;会用球棍模型、空间填充模型表示分子结构。4.知道构成物质的微粒之间存在不同的作用,了解分子间作用力和氢键。
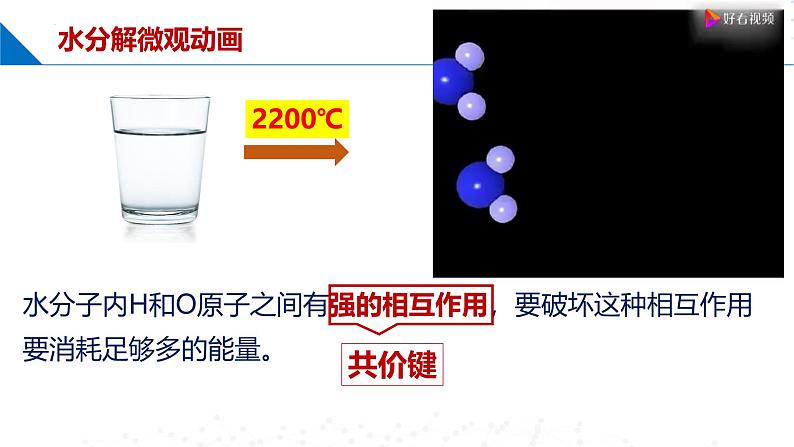
水分子内H和O原子之间有强的相互作用,要破坏这种相互作用要消耗足够多的能量。
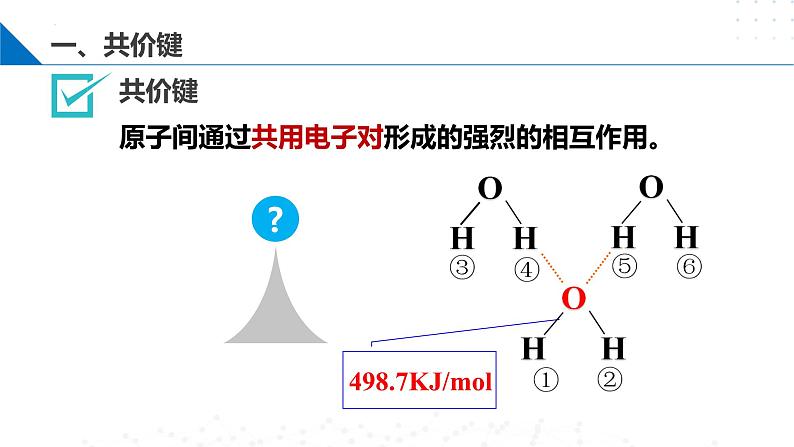
原子间通过共用电子对形成的强烈的相互作用。
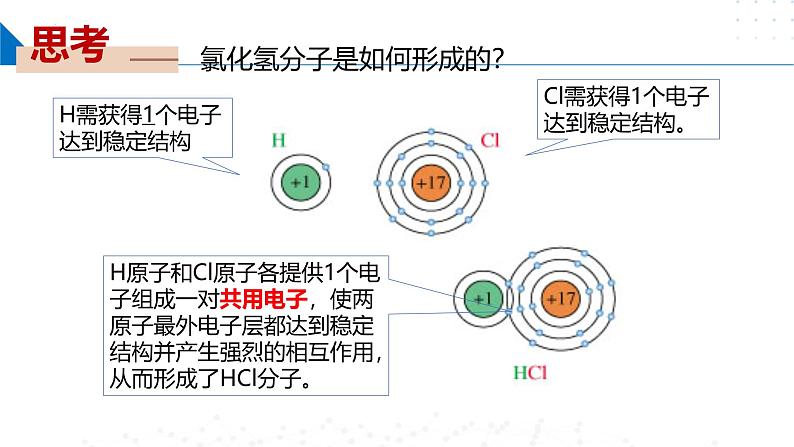
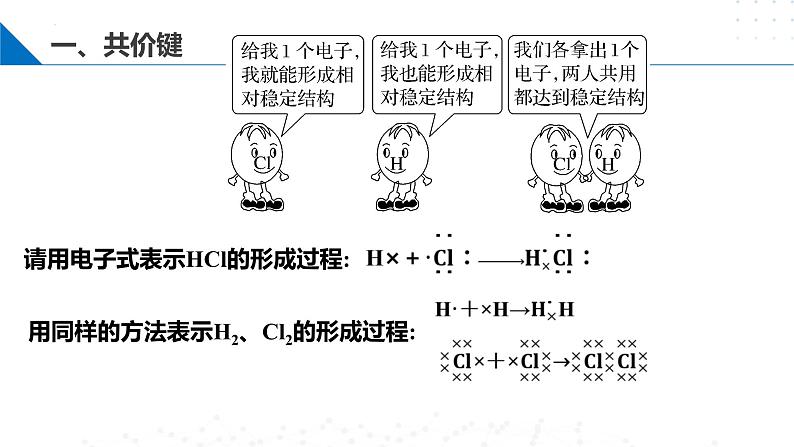
氯化氢分子是如何形成的?
H原子和Cl原子各提供1个电子组成一对共用电子,使两原子最外电子层都达到稳定结构并产生强烈的相互作用,从而形成了HCl分子。
H需获得1个电子达到稳定结构
Cl需获得1个电子达到稳定结构。
请用电子式表示HCl的形成过程:
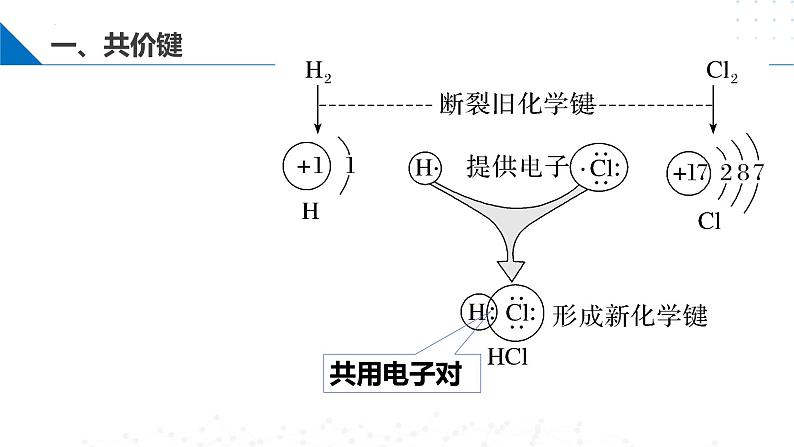
用同样的方法表示H2、Cl2的形成过程:
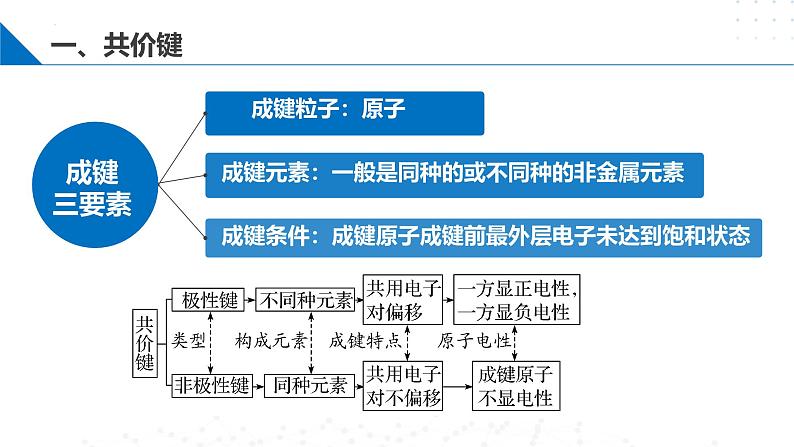
成键条件:成键原子成键前最外层电子未达到饱和状态
成键元素:一般是同种的或不同种的非金属元素
以共用电子对形成分子的化合物
如CH4、CH3CH2OH等
如NH3、H2S、H2O等
如CO、CO2、SO2等
如H2SO4、HNO3等
共价化合物中一定含有共价键,含有共价键的化合物一定是共价化合物吗?
不一定,某些离子化合物(如NaOH、NH4Cl等)中既含有离子键,也含有共价键,属于离子化合物。
原子之间全部以共价键结合的分子
电子式:如H2: ,N2: ,NH3: 。
写法:1.相同原子不能合并在一起2.没有形成离子,不标括号[ ]和电荷3.原子最外层电子达到稳定结构
化学上,常用“—”表示1对共用电子对,如氯分子可表示为“Cl—Cl”
: ,OH-: 。
用电子式表示含共价键的微粒
离子化合物MgCl2: ,Na2O: ,Na2O2: 。
HClO: ,CCl4: ,H2O2: ,NH3: 。
因为碳原子最外层有4个电子,既不易失电子,也不易得电子,所以易与其他原子以共价键相结合。碳原子最外层的4个电子,可以与其他原子分别形成4对共用电子对,达到8电子稳定结构。
为什么碳原子易形成共价键?
碳原子之间可以连成碳链或碳环。
碳原子成键方式的多样性,是有机化合物种类繁多的原因之一。
判断离子化合物和共价化合物的方法
(1)由化学键类型判断
只含有共价键的化合物是共价化合物,只含离子键或既含离子键又含共价键的化合物是离子化合物。
(2)由化合物类型判断
①活泼金属的氧化物(含过氧化物)和氢化物、强碱和大多数盐(少数盐如AlCl3、BeCl2等除外)属于离子化合物。
②非金属氧化物、非金属氢化物、含氧酸、多数有机化合物、少数盐(如AlCl3、BeCl2)属于共价化合物。
例1.(1)有下列物质:He、N2、CaO,CH4、Na2S、KOH、NaHCO3、Na2O2、NH4Cl、MgCl2。
①只含共价键的是 ;
②只含离子键的是 ;
③既含有共价键又含有离子键的是 ;
④属于共价化合物的是 ;
⑤属于离子化合物的是 。
N2、CH4CaO、Na2S、MgCl2 KOH、NaHCO3、Na2O2、NH4Cl CH4 CaO、Na2S、KOH、NaHCO3、Na2O2、NH4Cl、MgCl2
物质从固态转变为液态或气态,或从液态转变为气态,为什么要吸收能量?
干冰升华、硫晶体熔化、液氯汽化都要吸收能量。
分子之间存在着将分子聚集在一起的作用力
加热过程中物质的状态变化的微观模拟过程
固体→液体→气体的过程,分子间的距离不断被拉开,这个过程是分子吸收外界能量,克服分子间作用力;
由分子构成的物质,分子间作用力是影响物质熔、沸点和溶解性的重要因素之一。
分子间作用力比化学键弱得多。
例如,在常温下,氯、溴、碘单质分别呈气态、液态和固态,这与它们的分子间作用力大小有关
对于组成和结构相似的分子,其熔、沸点一般随着相对分子质量的增大(即范德华力变大)而升高。
Cl2、Br2 、I2的相对分子质量依次增大
研究表明,在有些分子之间还存在一种特殊的分子间作用力,称为氢键。
它比一般的分子间作用力强。
水的沸点较高,水结冰时体积膨胀、密度减小。水的这些特殊物理性质与水分子之间形成的氢键有关。
水蒸气中水分子主要以单个分子的形式存在,液态水中多个水分子通过氢键结合在一起,形成(H2O)n。
冰中所有水分子中的氢原子都参与形成氢键,使水分子之间的间隙增大,由此形成一个有很多“孔洞”的结构,使冰的密度小于水,所以冰浮于水上。
水分子之间形成氢键的示意图
2、氢键通常是物质在液态时形成的,但有时也存在于某些晶体或气态物质中,如氟化氢在三种状态下均存在氢键。
1、氢键是一种既可以存在于分子之间又可以存在于分子内部的作用力。
邻羟基苯甲醛分子内的氢键
氢键通常用X—H…Y 表示。其中X和Y代表电负性大而原子半径较小的非金属原子,如氟、氧、氮等。
化学键、分子间作用力与氢键的比较
例2.以下关于分子间作用力的叙述不正确的是( )
共价键形成过程电子式共价化合物
1.现有如下各种说法:
①在水中氢、氧原子间均以化学键相结合
②金属和非金属化合时一定形成离子键
③离子键是阳离子、阴离子间的相互吸引力
⑤H2分子和Cl2分子的反应是H2、Cl2分子里共价键发生断裂形成H、Cl,而后H、Cl形成共价键的过程
上述各种说法中正确的是( )
高中化学苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用背景图课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册<a href="/hx/tb_c4002509_t3/?tag_id=26" target="_blank">第二单元 微粒之间的相互作用背景图课件ppt</a>,共36页。PPT课件主要包含了学习目标,水分解微观动画,共价键,共用电子对,成键三要素,共价化合物,①非金属氢化物,②非金属氧化物,④大多数有机化合物,只含共价键等内容,欢迎下载使用。
必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用优质课ppt课件: 这是一份必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用优质课ppt课件,共60页。PPT课件主要包含了学习目标,必备知识·自主学习,共用电子对,成稳定的电子层结构,N≡N,HC≡CH,将分子聚集在一起,沸点和溶解性,关键能力·合作学习,提示HC≡N等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用图片课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用图片课件ppt,共36页。













