




高中苏教版 (2019)第二单元 微粒之间的相互作用教学演示ppt课件
展开学习目标: 1、 通过对Cl2、HCl形成过程的分析,理解共价键、共价化合物的涵义。 2、学会用电子式和结构式表示常见的几种共价分子。 3、认识球棍模型和空间填充模型,了解碳原子形成的共价键的多样性。 4、学会用电子式表示共价分子的形成过程。
活泼的金属元素和活泼非金属元素的原子之间化合时形成离子键。那么,非金属元素的原子之间能形成离子键吗?为什么?
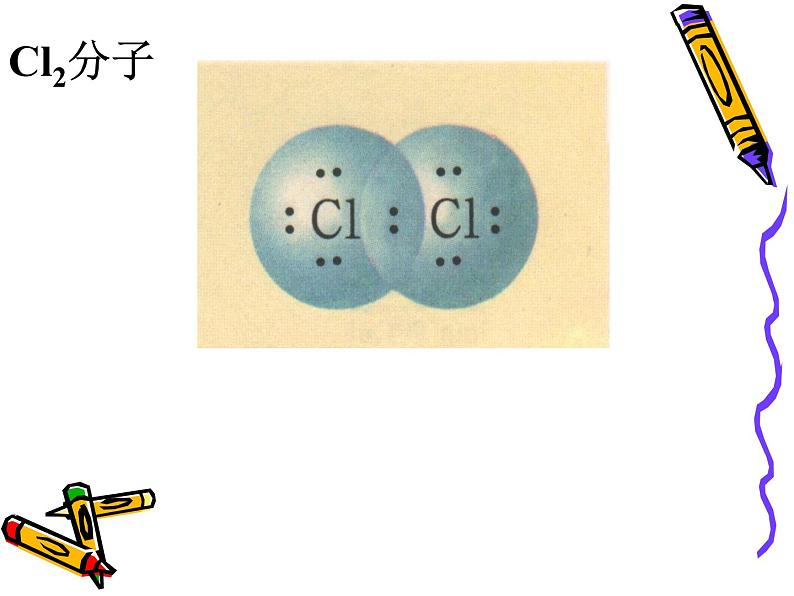
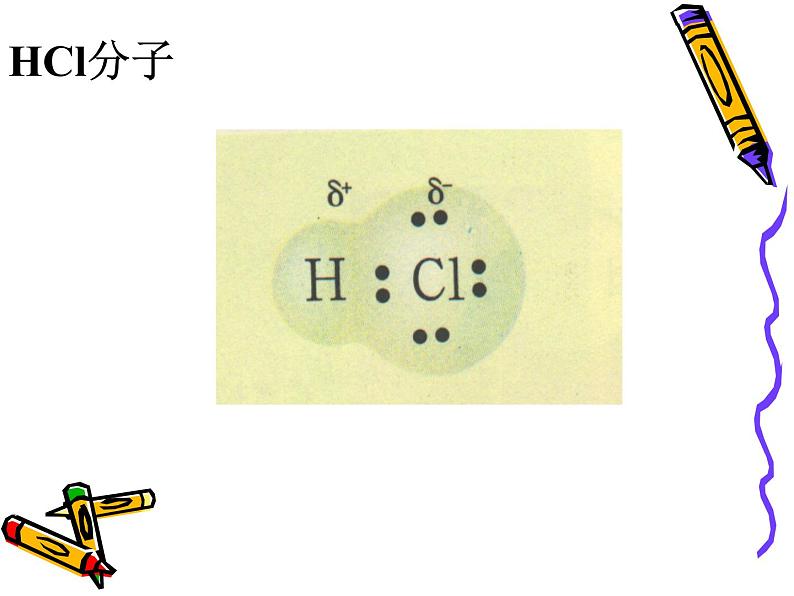
非金属元素的原子间可通过共用电子对使双方最外电子层均达到稳定结构。(如HCl的形成)
原子间通过共用电子对所形成的的化学键。
5.能形成共价键的元素:
一般情况,不活泼的金属元素与非金属元素间或非金属元素与非金属元素间(特殊的是AlCl3含共价键和铵盐如NH4Cl既含离子键又含共价键)
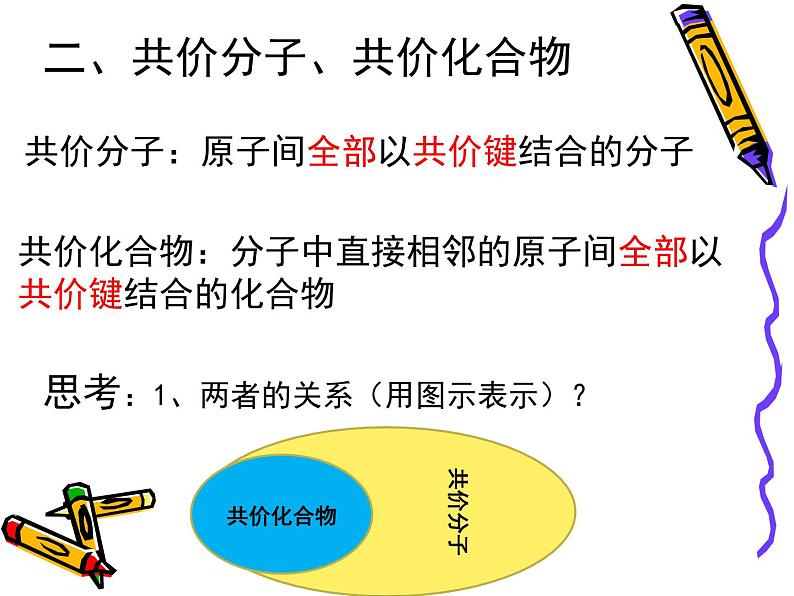
二、共价分子、共价化合物
共价分子:原子间全部以共价键结合的分子
共价化合物:分子中直接相邻的原子间全部以共价键结合的化合物
思考:1、两者的关系(用图示表示)?
思考:2、常见的共价分子、共价化合物属于哪些类别?
--大部分非金属氧化物
3、哪些类别的物质中含有共价键?
特殊稀有气体不含化学键
共用电子对标在成键两原子之间
三、共价分子的表示方法:
1、写出下列分子的电子式Cl2 HCl H2 H2O NH3
注意:每一个原子的最外层电子都标出,但相同的原子不能合并。
N2 HClO CH4 CO2
先写出成键的两原子的元素符号,
再在成键两原子之间标出共用电子对
最后在成键原子外围补出其他电子对,使其达到稳定结构
写出下列物质的电子式 NaOH NH4Cl NaClO Na2O2
[ H]-
[ ]-
[ ]2-
[ ]+
---原子间的一条短线表示一对共用电子对
V形 三角锥形 正四面体形 直线形
3、用电子式表示下列共价分子的形成过程
观察下图,分析各化合物分子中,每个碳原子能形成几个共价键,碳原子间是怎样连接的?
碳元素位于元素周期表第____周期____族,原子的最外层有___个电子。在化学反应中,碳原子既________,也_____________,通常与其它原子以_________键相结合。
一个碳原子可以形成____对共用电子对,碳原子可以与其它原子形成共价键,也可与碳原子之间形成碳碳____、________、__________。碳原子之间可以通过共价键彼此结合成碳链,也可连接成碳环。
二 ⅣA
有机物种类繁多的原因之一:__________________
碳原子间连接方式的多样性
学习目标:1、知道物质的微粒之间存在一种分子间作用力2、了解分子间作用力对物质的熔沸点、溶解性的影响3、知道一种特殊的分子间作用力:氢键
(1)水从液体变为气体时为什么要吸收能量?变化过程化学键是否被破坏,为什么?
(2)水电解生成氢气和氧气,水受热汽化成水蒸气。两种变化中,哪种是物理变化?哪种是化学变化?为什么?
许多事实证明,分子间存在着将分子聚集在一起的作用力,这种作用力称为“分子间作用力”。分子间作用力是影响物质熔沸点和溶解性的重要因素之一。
分子间作用力与化学键的区别
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:
但是:第2周期气态氢化物
为什么HF、H2O和NH3的沸点会反常呢?
1、 定义:由于氢原子的存在而使分子间产生的一种比分子间作用力稍强的相互作用——氢键。
2、氢键不属于化学键,比化学键弱得多,比分子间作用力稍强,也属于分子间作用力的范畴,
3、氢键的存在会影响物质的物理性质。
思考:为什么冰会浮在水面上?
例1:因冰晶体中,水分子间形成的氢键比液态水中多,导致冰的结构中出现较大的空隙,所以相同温度下冰的密度比水小,浮在水面上。
例2、HF、H2O和NH3的沸点比同主族其它氢化物的沸点高也是因HF、H2O和NH3分子间存在氢键
例3、NH3极易溶于水因H2O和NH3分子间形成氢键,增大在水中的溶解度。
含有共价键的化合物一定是共价化合物全部由非金属元素组成的化合物一定是共价化合物在气态单质分子里一定有共价键
错,如 NH4Cl 等铵盐
错,如:NaOH Na2SO4
错,He、Ne等稀有气体
● 只含有共价键的物质一定是共价化合物
2.下列物质中只有共价键的是( )A.NaOH B.NaCl C.H2 D.H2S
3.下列电子式中错误的是:( )
4、下列说法正确的是( )A.因水分子内存在氢键,所以水分子非常稳定B.氢键属于化学键C.水分子间存在氢键导致水的沸点较高D.水分子之间无分子间作用力,只有氢键
高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用课文内容课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用课文内容课件ppt,共35页。PPT课件主要包含了学业基础,共用电子对,共价键,不易失去,不易得到,碳碳单键,碳碳双键,碳碳三键,弱得多,分子间作用力等内容,欢迎下载使用。
必修 第一册第二单元 微粒之间的相互作用说课ppt课件: 这是一份必修 第一册第二单元 微粒之间的相互作用说课ppt课件,共35页。
高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用教课ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用教课ppt课件,共48页。PPT课件主要包含了分点突破1,共价键和共价化合物,分点突破2,分子间作用力和氢键,点击此处进入文档,基础全面练等内容,欢迎下载使用。













