





- 新教材适用2023_2024学年高中化学专题3微粒间作用力与物质性质第3单元共价键共价晶体第1课时共价键课件苏教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题3微粒间作用力与物质性质第3单元共价键共价晶体第2课时共价键键能与化学反应的反应热共价晶体课件苏教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题4分子空间结构与物质性质专题整合课件苏教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题4分子空间结构与物质性质第1单元分子的空间结构第1课时分子的空间结构模型课件苏教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题4分子空间结构与物质性质第1单元分子的空间结构第2课时分子的极性与手性分子课件苏教版选择性必修2 课件 0 次下载
高中化学苏教版 (2019)选择性必修2第四单元 分子间作用力 分子晶体课堂教学ppt课件
展开1.能举例说明不同类型分子间作用力的特征和实质,能运用范德华力和氢键解释、预测物质的物理性质。2.能描述典型分子晶体的结构特点,区分共价晶体和分子晶体。3.能列举生活中常见物质中存在的氢键,认识氢键在生命活动中扮演的重要角色。
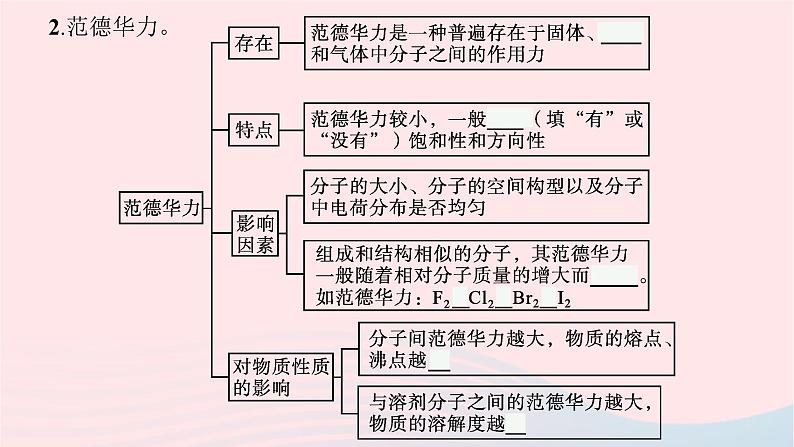
一、分子间作用力1.分子间作用力。(1)定义:共价分子间存在的一种相互作用。(2)本质: 静电 作用。(3)特点:比化学键弱得多。(4)类型:最常见的两种分子间作用力为范德华力和 氢键 。
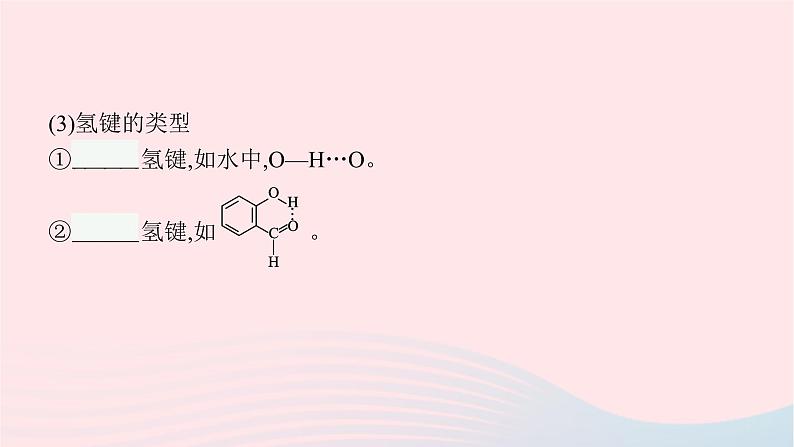
3.氢键。(1)形成与表示当H原子与电负性大、半径较小的原子X以共价键结合时,H原子能够跟另一个电负性大、半径较小的原子Y之间形成氢键。氢键通常用X—H…Y表示,其中X和Y代表电负性大而原子半径较小的非金属原子,如氟、氧、氮等。“—”表示共价键,“…”表示氢键。(2)氢键的特征①氢键比化学键弱,比范德华力强。②氢键具有一定的方向性和饱和性。
(3)氢键的类型①分子间氢键,如水中,O—H…O。②分子内氢键,如 。
(4)氢键对物质物理性质的影响①对物质熔、沸点的影响:分子间存在氢键的物质,物质的熔、沸点明显高,如熔、沸点NH3>PH3;同分异构体分子间形成氢键的物质比分子内形成氢键的物质熔、沸点高,如熔、沸点邻羟基苯甲酸<对羟基苯甲酸。②对物质溶解度的影响:溶剂和溶质之间形成氢键使溶质的溶解度增大,如NH3、甲醇、甲酸等易溶于水。③对物质密度的影响:氢键的存在会使某些物质的密度反常,如水的密度比冰的密度大。④对液体黏度的影响:含有分子间氢键的液体一般黏度较大,如甘油、浓硫酸等。
(5)生命分子中的氢键氢键对于生命非常重要,生物体内的蛋白质和DNA的分子内或分子间都存在大量的氢键。如DNA的双螺旋结构,它是由两条DNA大分子的碱基通过氢键配对形成的。(6)弱作用力的“强作用”——超分子化学中的万能相互作用“超分子”被称为共价键分子化学的一次升华,超分子化学被称为“超越分子概念的化学”。在形成超分子的各种分子间相互作用中,氢键尤为特殊,被称作为“超分子化学中的万能相互作用”。氢键的强度在化学键和范德华力之间,具有方向性和饱和性,使得它在超分子自组装过程中起着关键的作用。
【自主思考1】 H2O在乙醇中的溶解度大于H2S的,其原因是什么?提示:H2O与乙醇可以形成分子间氢键,使得水与乙醇互溶;而H2S与乙醇不能形成分子间氢键,故H2S在乙醇中的溶解度小于H2O。
二、分子晶体1.结构特点。 2.物理性质。分子晶体由于以比较弱的 分子间作用力 相结合,因此一般硬度 较小 ,熔点 较低 。
3.类型。【自主思考2】 分子晶体具有某些特征的本质原因是什么?提示:分子晶体相对于其他晶体来说,熔、沸点较低,硬度较小,本质原因是其基本构成微粒间的相互作用——范德华力及氢键相对于化学键来说比较弱。
三、石墨晶体1.结构特点。(1)石墨晶体是二维网状结构,在每一层内,每个碳原子以C—C键与 3 个碳原子结合,形成 六元环 层。(2)在同一层内,每个碳原子仅用了3个价电子形成共价键,还有1个电子处于碳原子的 2p 轨道上。层内碳原子的这些p轨道相互 平行 ,相邻碳原子的p轨道相互 重叠 ,形成 大π键 。(3)层与层之间以 分子间作用力 相结合。2.所属类型。石墨中既有 共价键 ,又有 范德华力 ,同时还有类似金属键的作用,是一种 混合 晶体。具有熔点 高 ,质软,易导电等性质。除石墨外,还有一些晶体,如CaI2、CdI2、MgI2等晶体,也同时存在着若干种不同的作用力和键型,都属于混合型晶体。
四、晶体的共性与个性1.晶体的共性。(1)晶体物质各个部分的宏观性质总是相同的,例如具有相同的密度、相同的化学组成等;(2)晶体总能自发地形成多面体外形;(3)晶体都具有确定的熔点。2.晶体的个性。
【效果自测】 1.判断正误,正确的画“√”,错误的画“×”。(1)分子晶体内只有分子间作用力。( )(2)分子晶体的相对分子质量越大,熔、沸点越高。( )(3)分子晶体中分子间氢键越强,分子越稳定。( )(4)冰融化时水分子中共价键发生断裂。( )(5)液态水和冰中都含有氢键。( )(6)分子晶体中一定存在范德华力,可能有共价键。( )
2.甲烷晶体的晶胞结构如图所示,下列说法正确的是( )。 A.甲烷晶胞中的球只代表1个C原子B.晶体中1个CH4分子有12个紧邻的CH4分子C.甲烷晶体熔化时需克服共价键D.1个CH4晶胞中含有8个CH4分子
解析:题图所示的甲烷晶胞中的球代表的是1个甲烷分子,并不是1个C原子,A项错误。由甲烷晶胞分析,位于晶胞顶点的某个甲烷分子与其距离最近的甲烷分子有3个,而这3个甲烷分子在晶胞的面上,因此每个都被2个晶胞共用,故与1个甲烷分子紧邻的甲烷分子数目为3×8× =12,B项正确。甲烷晶体是分子晶体,熔化时克服范德华力,C项错误。1个甲烷晶胞中含有甲烷分子的个数为 =4,D项错误。
3.(1)比较下列化合物熔、沸点的高低(填“>”或“<”)。①CO2 SO2;②NH3 PH3;③O3 O2;④Ne Ar;⑤CH3CH2OH CH3OH;⑥CO N2。 (2)已知AlCl3的熔点为190 ℃(2.02×105 Pa),但它在180 ℃即开始升华。①AlCl3固体是 晶体。 ②设计一个可靠的实验,判断氯化铝是离子化合物还是共价化合物。你设计的实验是 。答案:(1)①< ②> ③> ④< ⑤> ⑥>(2)①分子 ②在熔融状态下,验证其是否导电,若不导电则是共价化合物,若导电则是离子化合物解析:(2)由AlCl3的熔点较低以及在180 ℃时开始升华,可判断AlCl3晶体为分子晶体。若验证一种化合物是共价化合物还是离子化合物,可测其熔融状态下是否导电,若不导电则是共价化合物,若导电则是离子化合物。
碘晶体及其晶胞 干冰及其晶胞1.观察上面碘晶体、干冰晶体,思考组成分子晶体的微粒是什么?提示:组成分子晶体的微粒是分子。2.怎样判断一种晶体是否属于分子晶体?提示:依据物质的类别判断;依据组成晶体的微粒及微粒间作用判断;依据物质的性质判断。
分子晶体的判断方法(1)依据物质的类别判断。部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、大多数有机物的晶体都是分子晶体。(2)依据组成晶体的微粒及微粒间作用判断。组成分子晶体的微粒是分子,微粒间作用是分子间作用力。(3)依据物质的性质判断。分子晶体的硬度小,熔、沸点低,在熔融状态或固体时均不导电。
【例题1】 下列关于分子晶体的说法中,正确的是( )。A.晶体中分子间作用力越大,分子越稳定B.在分子晶体中一定存在共价键C.冰和固态Br2都是分子晶体D.稀有气体不能形成分子晶体答案:C解析:A项错误,分子间作用力影响物质的熔、沸点;B项错误,分子晶体中不一定存在共价键,如稀有气体中没有共价键;C项正确,冰和固态Br2均为分子晶体;D项错误,稀有气体的构成微粒是单原子分子,可形成分子晶体。
【变式训练1】 下列物质中,属于分子晶体的是( )。①二氧化硅 ②碘 ③食盐 ④蔗糖 ⑤磷酸A.②④⑤B.①②④C.③④⑤D.①②③⑤答案:A解析:由常见分子晶体对应的物质类别可知:碘、蔗糖、磷酸都属于分子晶体。
常温下,液态水中水分子在不停地做无规则的运动。0 ℃以下,水凝结成冰,其中水分子的排列由杂乱无序变得十分有序(如下图所示)。
1.思考冰晶体中存在哪几种微粒间的相互作用?提示:冰晶体中存在氢键、分子间作用力。2.冰中微粒间的相互作用对冰晶体的结构与性质产生了怎样的影响?提示:在冰晶体中由于水分子之间的主要作用力是氢键,氢键跟共价键一样具有方向性,即氢键的存在迫使在四面体中心的每个水分子与四面体顶点方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙。当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大。因冰中除了范德华力外还有氢键作用,破坏分子间作用力较难,所以熔、沸点高。
1.分子晶体的物理性质。(1)分子晶体具有较低的熔、沸点和较小的硬度。分子晶体熔化时要破坏分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,部分分子晶体易升华(如干冰、碘等),且硬度较小。(2)分子晶体不导电。分子晶体在固态和熔融状态下均不存在自由移动的离子或自由电子,因而分子晶体在固态和熔融状态下都不能导电。有些分子晶体的水溶液能导电,如HI、乙酸等。
2.分子晶体熔、沸点的比较规律。(1)少数主要以氢键作用形成的分子晶体,比一般的分子晶体的熔、沸点高,如含有H—F键、H—O键、H—N键等共价键的分子间可以形成氢键,所以HF、H2O、NH3、醇、羧酸等物质的熔、沸点相对较高。(2)组成与结构相似,分子之间不含氢键而主要利用范德华力形成的分子晶体,随着相对分子质量的增大,物质的熔、沸点逐渐升高。例如,常温下Cl2呈气态,Br2呈液态,而I2呈固态;CO2呈气态,CS2呈液态。(3)有机物中组成和结构相似且不存在氢键的同分异构体,相对分子质量相同,一般支链越多,分子间的相互作用力越弱,熔、沸点越低,如熔、沸点:正戊烷>异戊烷>新戊烷。
【例题2】 下列有关分子晶体熔点高低的叙述中,正确的是( )。A.Cl2>I2B.SiCl4>CCl4C.PH3>NH3D.C(CH3)4>CH3CH2CH2CH2CH3答案:B解析:NH3分子间存在氢键,分子间作用力大,PH3分子间不存在氢键,分子间作用力弱,NH3的熔点高于PH3,C项不正确;A、B项中均无氢键,且固态时都为分子晶体,物质组成结构相似,相对分子质量大的熔点高,A项不正确,B项正确;相对分子质量相同的烷烃的同分异构体,支链越多,熔点越低,D项不正确。
【变式训练2】 下列属于分子晶体性质的是( )。A.熔点1 070 ℃,易溶于水,水溶液能导电B.能溶于CS2,熔点112.8 ℃,沸点444.6 ℃C.熔点1 400 ℃,可作半导体材料,难溶于水D.熔点97.81 ℃,质软,导电,密度0.97 g·cm-3答案:B解析:通常分子晶体的主要性质有熔、沸点低,硬度小;晶体不导电,熔化时也不导电。
苏教版 (2019)选择性必修2第三单元 共价键 共价晶体课文内容ppt课件: 这是一份苏教版 (2019)选择性必修2第三单元 共价键 共价晶体课文内容ppt课件,共42页。PPT课件主要包含了内容索引,自主预习新知导学,合作探究释疑解惑,课堂小结,素养阐释,共价键的特征,问题引领,归纳提升,典型例题,共价键的分类等内容,欢迎下载使用。
化学选择性必修2第二单元 离子键 离子晶体课前预习课件ppt: 这是一份化学选择性必修2第二单元 离子键 离子晶体课前预习课件ppt,共27页。PPT课件主要包含了内容索引,自主预习新知导学,合作探究释疑解惑,课堂小结,素养阐释,问题引领,归纳提升,典型例题等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修2第一单元 金属键 金属晶体说课ppt课件: 这是一份高中化学苏教版 (2019)选择性必修2第一单元 金属键 金属晶体说课ppt课件,共33页。PPT课件主要包含了内容索引,自主预习新知导学,合作探究释疑解惑,课堂小结,素养阐释,问题引领,归纳提升,典型例题等内容,欢迎下载使用。













