

- 4.2 第2课时 羧酸的性质及应用 学案 2023-2024学年高二化学苏教版(2020)选择性必修第三册 学案 2 次下载
- 4.2 第3课时 酯化反应的类型 酯的性质 学案 2023-2024学年高二化学苏教版(2020)选择性必修第三册 学案 2 次下载
- 5.2 胺和酰胺 学案 2023-2024学年高二化学苏教版(2020)选择性必修第三册 学案 2 次下载
- 5.3 第1课时 有机物基团间的相互影响 重要有机物相互之间的转化 学案 2023-2024学年高二化学苏教版(2020)选择性必修第三册 学案 2 次下载
- 5.3 第2课时 有机合成的一般过程 学案 2023-2024学年高二化学苏教版(2020)选择性必修第三册 学案 2 次下载
高中化学苏教版 (2019)选择性必修3专题5 药物合成的重要原料——卤代烃、胺、酰胺第一单元 卤代烃学案
展开1.认识卤代烃的组成和结构特点,能根据不同的标准对卤代烃进行分类。
2.通过对1-溴丙烷和2-溴丙烷性质的学习掌握卤代烃的性质,认识消去反应的原理。
3.知道卤代烃在有机合成中的重要应用。
【合作探究】
【学习情境】
体育比赛中,当运动员肌肉挫伤或扭伤时,队医随即对准伤员的受伤部位喷射某种气雾剂,进行局部冷冻麻醉应急处理,稍后运动员又可上场了。那么这种气雾剂的主要成分是什么呢?这种气雾剂的主要成分是氯乙烷,它的沸点低,易汽化,且汽化时吸收大量的热,使受伤部位温度急剧下降,局部暂时失去知觉,达到麻醉的效果。氯乙烷属于卤代烃,卤代烃有怎样的性质呢?
任务1 卤代烃的组成、结构、分类和物理性质
【新知生成】
1.概念与分类
(1)概念:烃分子中的氢原子被 原子取代后生成的化合物,官能团是碳卤键,组成元素为C、X和H。
(2)分类:
a.按卤原子的多少分:一卤代烃和多卤代烃。
b.按取代卤原子的不同分:氟代烃、氯代烃、溴代烃、碘代烃。
c.按烃基结构的不同分:卤代烷烃、卤代烯烃、卤代芳香烃等。
2.物理性质
(1)状态
常温下,卤代烃除少数为气体外,如一氯甲烷、氯乙烷、氯乙烯等,大多数卤代烃为液体或固体。
(2)溶解性
卤代烃 水,易溶于乙醚、苯、环己烷等有机溶剂。
(3)密度:除脂肪烃中的一氟代烃等部分卤代烃外,液态卤代烃的密度一般比水 。
(4)沸点:卤代烃的沸点比同碳原子数的烷烃的沸点 ;通常情况下,互为同系物的一卤代直链烷烃的沸点随碳原子数及卤素的相对原子质量的增加而升高。
(5)气味:大多数卤代烃都具有特殊气味。
【答案】1.卤素 2.(2)不溶于 (3)大 (4)高
【核心突破】
典例1 下列关于卤代烃的叙述错误的是( )。
A.随着碳原子数的增多,一氯代烃的沸点逐渐升高
B.随着碳原子数的增多,一氯代烃的密度逐渐增大
C.相同碳原子数的一氯代烃,支链越多,沸点越低
D.相同碳原子数的一卤代烃,卤素的原子序数越大,沸点越高
【答案】B
【解析】随着碳原子数的增多,一氯代烃的沸点逐渐升高,A项正确;随着碳原子数的增多,一氯代烃的密度逐渐减小,B项错误;相同碳原子数的一氯代烃,支链越多,分子间距离越大,分子间作用力越小,沸点越低,C项正确;相同碳原子数的一卤代烃,卤素的原子序数越大,相对分子质量越大,分子间作用力越大,沸点越高,D项正确。
【归纳总结】
1.饱和一卤代烃的分子通式:CnH2n+1X(X代表F、Cl、Br、I)
2.卤代烃的密度与沸点
(1)卤代烃的密度和沸点都高于相应的烃;
(2)卤原子相同的饱和一卤代烃的密度一般随烃基中碳原子数目的增加而减小,如ρ(CH3Cl)>ρ(CH3CH2Cl);具有相同烃基的卤代烃密度按氟代烃、氯代烃、溴代烃、碘代烃的顺序增大;
(3)卤代烃的沸点一般随碳原子数目的增加、卤原子个数的增多、卤原子原子序数的增大而升高,如沸点CH3Cl
命名为2-氯丁烷
命名为1,2-二溴乙烷
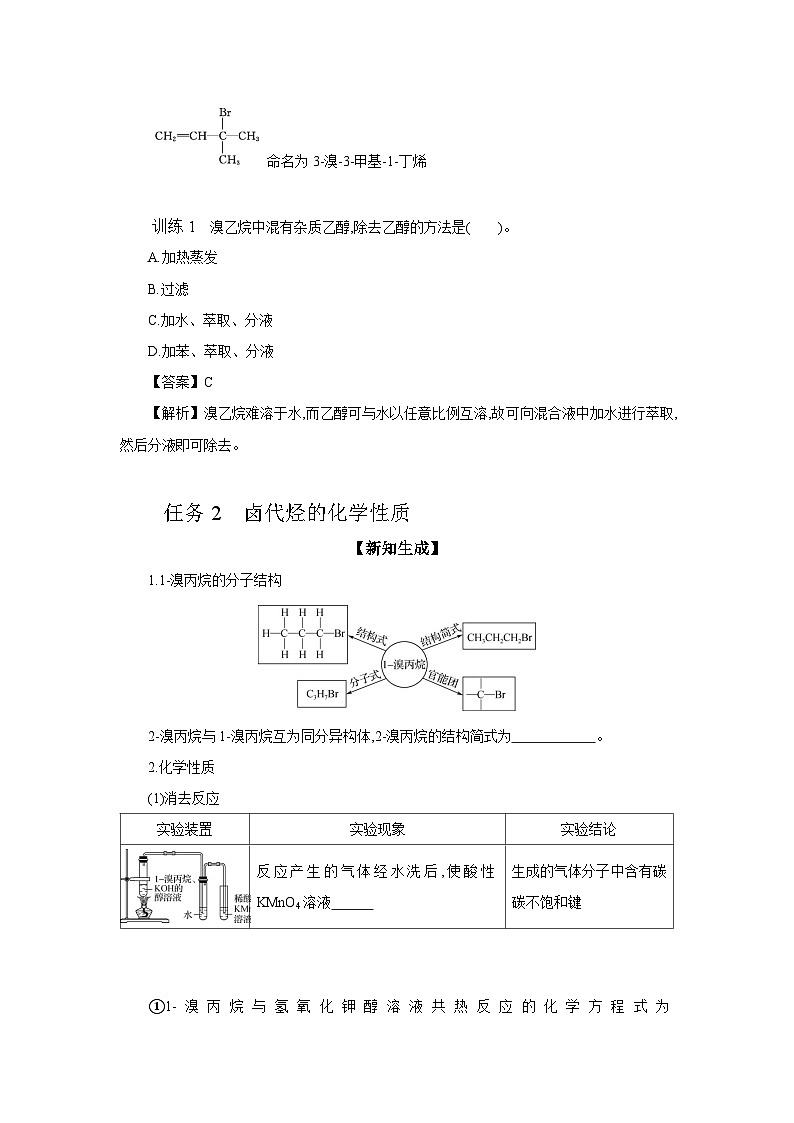
命名为3-溴-3-甲基-1-丁烯
训练1 溴乙烷中混有杂质乙醇,除去乙醇的方法是( )。
A.加热蒸发
B.过滤
C.加水、萃取、分液
D.加苯、萃取、分液
【答案】C
【解析】溴乙烷难溶于水,而乙醇可与水以任意比例互溶,故可向混合液中加水进行萃取,然后分液即可除去。
任务2 卤代烃的化学性质
【新知生成】
1.1-溴丙烷的分子结构
2-溴丙烷与1-溴丙烷互为同分异构体,2-溴丙烷的结构简式为 。
2.化学性质
(1)消去反应
①1-溴丙烷与氢氧化钾醇溶液共热反应的化学方程式为CH3CH2CH2Br+KOH 。
②消去反应:在一定条件下,从一个有机化合物分子中脱去一个或几个小分子生成 化合物(含 )的反应。
(2)取代反应(水解反应)
由实验可知
a.2-溴丙烷与氢氧化钾溶液共热时断裂的是 键,水中的羟基与碳原子形成 键,剩下的Br与水中的H结合成HBr。
b.2-溴丙烷与KOH水溶液共热反应的化学方程式为+KOH ;反应类型为 。
【答案】1. 2.(1)褪色
①CH3CHCH2↑+KBr+H2O ②不饱和 双键或三键 (2)C—Br C—O +KBr 取代反应
【核心突破】
典例2 下列化合物中能发生消去反应生成两种烯烃,又能发生水解反应的是( )。
A.CH3Cl
B.
C.
D.
【答案】D
【解析】四种物质都属于氯代烃,都可以发生水解反应;CH3Cl只有1个碳原子;中与氯原子相连的碳原子的邻位碳原子上没有氢原子,两者均不能发生消去反应;发生消去反应后只能生成一种烯烃();发生消去反应后可以得到两种烯烃(、)。
典例3 为了检验某氯代烃中的氯元素,现进行如下操作,其中合理的是( )。
A.取氯代烃少许,加入AgNO3溶液
B.取氯代烃少许与NaOH水溶液共热,然后加入AgNO3溶液
C.取氯代烃少许与NaOH水溶液共热后,加入稀硝酸酸化,再加入AgNO3溶液
D.取氯代烃少许与NaOH乙醇溶液共热后,加入稀盐酸酸化,再加入AgNO3溶液
【答案】C
【解析】由于卤代烃中的氯元素并非自由移动的Cl-,故检验卤代烃中是否含有氯元素时,应先加入NaOH溶液(或NaOH醇溶液),并加热,先使卤代烃发生水解(或消去)反应,产生Cl-,然后加入稀硝酸酸化,再加AgNO3溶液,根据产生白色沉淀确定卤代烃中含有氯元素。先加硝酸酸化,是为了防止NaOH与AgNO3反应生成AgOH,再转化为褐色的Ag2O沉淀而干扰检验。
【归纳总结】
1.卤代烃消去反应的规律
(1)没有邻位碳原子的卤代烃不能发生消去反应,如CH3Cl。
(2)邻位碳原子上无氢原子的卤代烃不能发生消去反应,如、。
(3)有两个邻位不对称的碳原子,且邻位碳原子上均有氢原子时,可得到不同产物。
如:+NaOHNaCl+CH2CH—CH2—CH3(或CH3—CHCH—CH3)+H2O
(4)卤代烃发生消去反应可生成炔烃。
型卤代烃,发生消去反应可以生成R—C≡C—R,如BrCH2CH2Br+2NaOHCH≡CH↑+2NaBr+2H2O。
2.卤代烃水解反应和消去反应的比较
3.卤代烃中卤族元素的检验方法
注意:卤代烃水解完成后,检验卤离子前,应先加硝酸使溶液呈酸性再加AgNO3溶液。
训练2 为探究1-溴丙烷(CH3CH2CH2Br)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙、丁四位同学分别设计如下四个实验方案。
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成,则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
丁:将反应产生的气体先水洗后再通入酸性高锰酸钾溶液中,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )。
A.甲 B.乙
C.丙 D.丁
【答案】D
【解析】1-溴丙烷无论发生水解反应还是消去反应,溶液中都含有NaBr、醇和NaOH,向溶液中加入AgNO3(HNO3)都会产生浅黄色沉淀,甲错误;NaOH也会与溴水反应使之褪色,乙错误;醇也能被酸性KMnO4溶液氧化而使之褪色,丙错误;反应产生的气体经水洗可除去醇,若仍能使酸性KMnO4溶液褪色,说明生成了含不饱和键的物质,即发生了消去反应,丁正确。
任务3 卤代烃的应用
【新知生成】
1.卤代烃的用途与危害
(1)用途:制冷剂、灭火剂、溶剂、麻醉剂、合成药物和农药、高聚物(如聚氯乙烯、聚四氟乙烯等)。
(2)危害:氟氯烃可对臭氧层产生破坏作用,形成臭氧空洞,危及地球上的生物。
2.卤代烃的获取方法
(1)不饱和烃与卤素单质、卤化氢等的加成反应
如CH3—CHCH2+Br2→ 。
CH3—CHCH2+HBr 。
CH≡CH+HCl 。
(2)取代反应
如乙烷与Cl2:CH3CH3+Cl2 +HCl
苯与Br2:+Br2 +HBr
C2H5OH与HBr:C2H5OH+HBr +H2O。
【答案】2.(1)CH3CHBrCH2Br CH2CHCl (2)CH3CH2Cl C2H5Br
【核心突破】
典例4 根据下面的反应路线及所给信息填空。
AB
(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ,③的反应类型是 。
(3)反应④的化学方程式是 。
【答案】(1) 环己烷 (2)取代反应 加成反应 (3)+2NaOH+2NaBr+2H2O
【解析】由A可知该反应为取代反应,则A为环己烷(),又分子中含有碳碳双键,故与Br2的CCl4溶液发生加成反应而生成B,化学方程式为+Br2,比较B与的结构可知,B发生消去反应生成,化学方程式为+2NaOH+2NaBr+2H2O。
【归纳总结】
卤代烃在有机合成中的应用
(1)引入羟基:通过卤代烃的水解反应会引入—OH:R—X+NaOHROH+NaX。
(2)引入不饱和键:通过卤代烃的消去反应可引入碳碳双键、碳碳三键:+NaX+H2O。
(3)改变官能团的位置
通过卤代烃的消去反应获得烯烃,再通过烯烃与HX在一定条件下的加成反应,又得到卤代烃,但卤素原子的位置发生了变化。例如以1-溴丙烷为主要原料,选择相应试剂制取少量2-溴丙烷,制取过程示例如下:CH3CH2CH2BrCH3CHCH2 CH3CHBrCH3。
(4)改变官能团的数目
通过卤代烃的消去反应获得烯烃,再通过烯烃与X2的加成反应,得到二卤代烃。例如以1-溴丙烷为主要原料,选择相应试剂制取少量1,2-二溴丙烷,制取过程示例如下:CH3CH2CH2Br CH3CHCH2CH3CHBrCH2Br。
(5)增长碳链或构成碳环
卤代烃能与多种金属作用,生成金属有机化合物,其中格氏试剂是金属有机化合物中最重要的一类化合物,是有机合成中非常重要的试剂之一,它是卤代烃在乙醚的存在下与金属镁作用,生成有机镁化合物,再与活泼的卤代烃反应,生成更长碳链的烃:
RX+MgRMgX,CH2CHCH2Cl+RMgCl→CH2CHCH2R+MgCl2。
训练3 由2-氯丙烷制取少量1,2-丙二醇时,需要经过的几步反应是( )。
A.消去、加成、取代
B.加成、消去、取代
C.取代、消去、加成
D.消去、加成、消去
【答案】A
【解析】由2-氯丙烷制取少量1,2-丙二醇,可用逆推法判断:CH3CH(OH)CH2OHCH3CHBrCH2BrCH3CHCH2CH3CHClCH3,则2-氯丙烷应首先发生消去反应生成CH3CHCH2,CH3CHCH2发生加成反应生成CH3CHBrCH2Br,CH3CHBrCH2Br发生水解反应可生成1,2-丙二醇。
【课堂小结】
【随堂检测】
1.下列物质中,不属于卤代烃的是( )。
A.CH2Cl2B.CCl2F2
C.D.
【答案】C
【解析】是苯中的氢原子被硝基取代的化合物,属于硝基化合物,不属于卤代烃。
2.下列关于卤代烃的叙述正确的是( )。
A.所有卤代烃都是难溶于水,比水重的液体
B.所有卤代烃在适当条件下都能发生消去反应
C.所有卤代烃都含有卤原子,都能发生取代反应
D.所有卤代烃都是通过取代反应制得的
【答案】C
【解析】CH3Cl等呈气态,A项错误;CH3Cl等不能发生消去反应,B项错误;卤代烃中都含有卤原子,都能发生取代反应,C项正确;卤代烃可以通过加成反应制得,如乙烯与Br2发生加成反应制得BrCH2CH2Br,D项错误。
3.为检验某卤代烃(R—X)中的X元素,有下列实验操作:①加热 ②加入AgNO3溶液 ③取少量卤代烃 ④加入稀硝酸酸化 ⑤加入NaOH溶液 ⑥冷却,正确操作的先后顺序是( )。
A.③①⑤⑥②④B.③①②⑥④⑤
C.③⑤①⑥④②D.③⑤①⑥②④
【答案】C
【解析】检验某卤代烃(R—X)中的X元素,应该先取少量卤代烃,卤代烃的水解应在碱性条件下,即向卤代烃中加入氢氧化钠溶液,加热加快反应速率,然后冷却液体,因为银离子与氢氧根离子会反应生成沉淀,干扰卤素离子的检验,因此向水解后的溶液中加入稀硝酸使溶液酸化,再加入硝酸银溶液,观察是否生成沉淀和沉淀颜色,所以其操作顺序是③⑤①⑥④②。
4.下列关于甲、乙、丙、丁四种有机物的说法正确的是( )。
CH3Cl甲 乙
丙 丁
A.分别加入AgNO3溶液,均有沉淀生成
B.均能在一定条件下与NaOH的水溶液反应
C.均能在一定条件下与NaOH的醇溶液反应
D.乙发生消去反应得到两种烯烃
【答案】B
【解析】四种物质都不能电离出卤素离子,与AgNO3溶液不反应,A项错误;四种物质均为卤代烃,均能与NaOH的水溶液在共热的条件下发生取代反应,B项正确;甲、丙、丁与NaOH的醇溶液共热,不能发生消去反应,乙中加入NaOH的醇溶液共热能发生消去反应,C项错误;乙中与溴原子相连的碳原子的相邻碳原子上只有1种氢原子,发生消去反应只能生成1种烯烃,D项错误。
5.卤代烃的取代反应可看作带负电荷的原子团取代了卤代烃中的卤素原子。例如:CH3Br+OH-(或NaOH)CH3OH+Br-(或NaBr)(反应条件已略去)。下列反应的化学方程式中不正确的是( )。
A.CH3CH2Br+NaHSCH3CH2SH+NaBr
B.CH3I+NaCNCH3CN+NaI
C.CH3CH2Cl+CH3ONaCH3Cl+CH3CH2ONa
D.CH3CH2Cl+NH3CH3CH2NH2+HCl
【答案】C
【解析】NaHS中HS-带负电荷,取代溴代烃中的溴原子,A项正确;NaCN中CN-带负电荷,取代碘代烃中的碘原子,B项正确;CH3ONa中CH3O-带负电荷,取代氯代烃中的氯原子,反应生成CH3CH2OCH3和NaCl,C项错误;NH3中NH2-带负电荷,取代氯代烃中的氯原子,D项正确。实验装置
实验现象
实验结论
反应产生的气体经水洗后,使酸性KMnO4溶液
生成的气体分子中含有碳碳不饱和键
实验装置
实验现象
①中溶液分层
②中有机层厚度减小,直至消失
④中有黄色沉淀生成
实验结论
2-溴丙烷与KOH溶液共热产生了Br-
反应类型
取代反应(水解反应)
消去反应
反应条件
强碱的水溶液、加热
强碱的醇溶液、加热
断键方式
X+H—OH
反应本质
和通式
卤代烃分子中—X被水中的—OH所取代,生成醇:
R—CH2—X+NaOHR—CH2OH+NaX
相邻的两个碳原子间脱去小分子HX:
+NaOH+NaX
+H2O
产生特征
引入—OH,生成含—OH的化合物
消去HX,生成含不饱和键(碳碳双键或碳碳三键)的化合物
巧记
卤代烃取代反应和消去反应的条件和产物:无醇(水溶液)则有醇(生成醇),有醇(醇溶液)则无醇(产物中没有醇)。
实验步骤
实验原理
①取少量卤代烃于试管中
②加入NaOH溶液
③加热
R—X+NaOHROH+NaX
④冷却
⑤加入稀硝酸酸化
HNO3+NaOHNaNO3+H2O
⑥加入AgNO3溶液
AgNO3+NaXAgX↓+NaNO3
实验流程
苏教版 (2019)选择性必修3第二单元 胺和酰胺学案及答案: 这是一份苏教版 (2019)选择性必修3<a href="/hx/tb_c4009364_t4/?tag_id=42" target="_blank">第二单元 胺和酰胺学案及答案</a>,共8页。学案主要包含了学习目标,合作探究,学习情境,新知生成,核心突破,归纳总结,课堂小结,随堂检测等内容,欢迎下载使用。
化学人教版 (2019)第一节 卤代烃学案设计: 这是一份化学人教版 (2019)第一节 卤代烃学案设计,共6页。学案主要包含了学习目标,学习过程,实验3-1,课后限时作业等内容,欢迎下载使用。
人教版 (2019)选择性必修3第一节 卤代烃学案: 这是一份人教版 (2019)选择性必修3第一节 卤代烃学案,共4页。学案主要包含了卤代烃,溴乙烷的结构与性质,卤代烃破坏臭氧层原理等内容,欢迎下载使用。













