



必修 第一册第二节 元素周期律多媒体教学ppt课件
展开本课件内嵌有高清视频供老师参考使用视频:第三周期元素性质的递变本页可自行删除
认识同周期元素的核外电子排布、主要化合价、原子半径等性质的周期性变化规律。以第三周期元素为例,掌握同周期主族元素金属性和非金属性的递变规律。
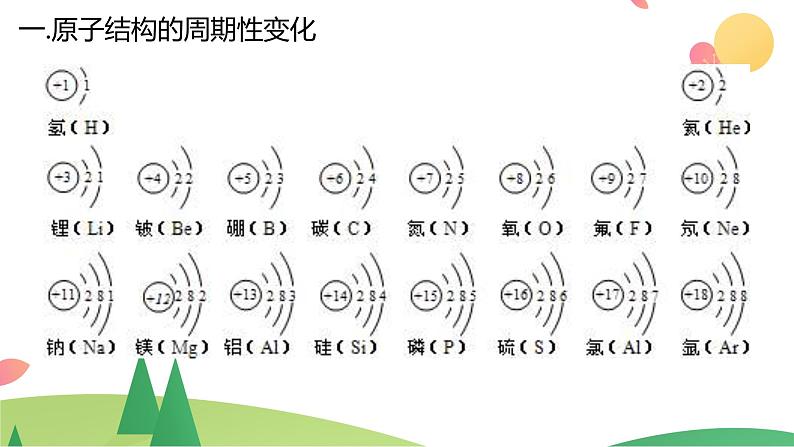
一.原子结构的周期性变化
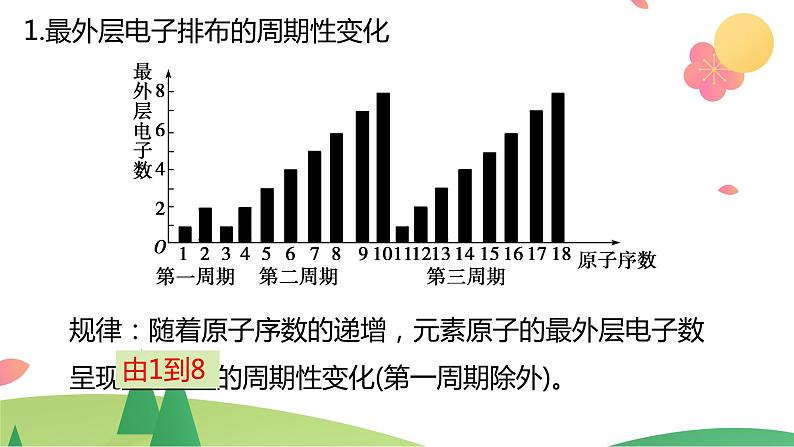
1.最外层电子排布的周期性变化
规律:随着原子序数的递增,元素原子的最外层电子数呈现 的周期性变化(第一周期除外)。
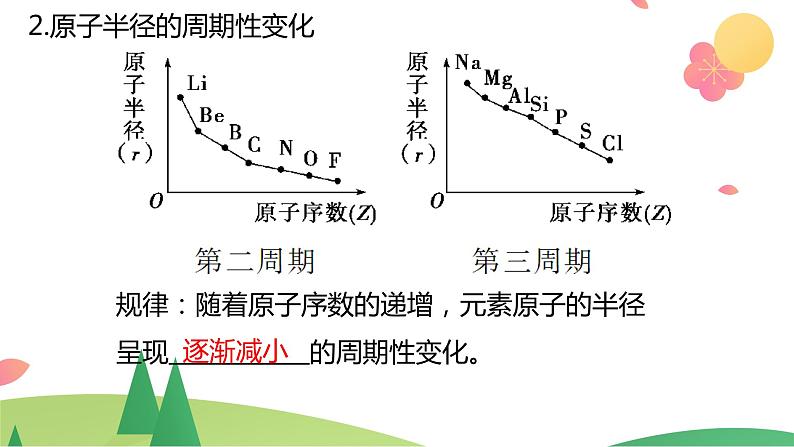
2.原子半径的周期性变化
规律:随着原子序数的递增,元素原子的半径呈现 的周期性变化。
3.元素主要化合价的周期性变化 以1—18号元素为例
规律:随着原子序数的递增,元素的最高正化合价呈现+1→+7(O、F除外),最低负化合价呈现-4→-1的周期性变化。
取决于原子最外层电子数的周期性变化
二.第三周期元素性质的递变
1. 钠、镁、铝的性质比较:
(1)概念既能与强酸反应又能与强碱反应,且均生成盐和水的氢氧化物。(2)氢氧化铝的两性①向AlCl3溶液中加入过量氨水,现象:产生白色沉淀;反应方程式:AlCl3+3NH3·H2O==3NH4Cl+Al(OH)3↓②向AlCl3溶液中逐滴加入NaOH溶液至过量,现象:先产生白色沉淀,后白色沉淀溶解,反应方程式:AlCl3+3NaOH==3NaCl+Al(OH)3↓ NaOH+Al(OH)3==NaAlO2+2H2O③向Al(OH)3沉淀中加入盐酸,发生反应的离子方程式: Al(OH)3+3H+===Al3++3H2O
3. 硅、磷、硫、氯的性质比较
(1)第三周期元素性质变化规律: 从Na Cl ,金属性逐渐 ,非金属性逐渐 。(2)同周期元素性质递变规律:从左 右,金属性逐渐 ,非金属性逐渐 。
1. 内容:元素的性质随着原子序数的递增而呈现周期性的变化。2. 实质:是原子核外电子排布呈现周期性变化的结果。3. 元素性质的周期性变化规律
方法:元素金属性、非金属性强弱比较
(1)结构比较法最外层电子数 ,电子层数 ,元素金属性越强;最外层电子数 ,电子层数 ,元素非金属性越强。(2)位置比较法
元素周期表中,同主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,失电子能力逐渐增强,金属性逐渐增强。1.单质与水(或酸)反应置换出氢气的难易程度;2.最高价氧化物对应水化物——氢氧化物的碱性强弱;3.金属活动顺序表;4.金属单质之间的置换反应;如Zn+Fe2+==Zn2++Fe5.对应简单阳离子的氧化性强弱;6.元素周期律。
元素周期表中,同主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。1.最高价氧化物对应水化物的酸性强弱;2.单质与氢气生成气态氢化物的难易程度;3.气态氢化物的稳定性;4.非金属活动顺序;5.非金属单质之间的置换反应;如Cl2+2Br-==2Cl-+Br26.对应简单阴离子的氧化性强弱;7.元素周期律。
1.(2021·北京昌平·高一期末)下列事实不能用元素周期律解释的是A.非金属性:S<OB.气态氢化物的稳定性:H2O>NH3C.酸性:HCl>H2SD.还原性:K>Na【答案】C
2.下列各组物质的性质由强到弱的顺序排列正确的是A.酸性:HClO4>H3PO4>H2SO4B.氢化物稳定性:H2S>HF>H2OC.碱性:NaOH>Al(OH)3>Mg(OH)2D.还原性:HI>HBr>HCl>HF【答案】D
3.下图为周期表中短周期的一部分。已知a原子的最外层电子数是电子总数的1/3,下列说法中正确的是A.a的最高价氧化物对应水化物有两性B.b与d组成的化合物不能与水反应C.c的单质能与强碱反应生成两种盐D.非金属性:a>b>c【答案】C
4.下列事实不能说明元素的金属性或非金属性相对强弱的是【答案】C
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表背景图ppt课件: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161996_t3/?tag_id=26" target="_blank">第一节 原子结构与元素周期表背景图ppt课件</a>,共29页。PPT课件主要包含了考纲要求,一碱金属元素,思考与交流,碱金属的化学性质,碱金属的物理性质,二卤族元素等内容,欢迎下载使用。
人教版 (2019)第一节 原子结构与元素周期表说课ppt课件: 这是一份人教版 (2019)<a href="/hx/tb_c161996_t3/?tag_id=26" target="_blank">第一节 原子结构与元素周期表说课ppt课件</a>,共27页。PPT课件主要包含了考纲要求,周期和族,元素位置等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 氯及其化合物授课ppt课件: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161981_t3/?tag_id=26" target="_blank">第二节 氯及其化合物授课ppt课件</a>,共31页。PPT课件主要包含了考纲要求,氯的原子结构,结构决定性质,氯气的性质,氯气的物理性质,氯气的化学性质,不一定需要氧气的参与,NaClO,CaClO2等内容,欢迎下载使用。













