



化学第二节 元素周期律课文内容ppt课件
展开1. 掌握元素化合价随原子序数的递增而呈现出的周期性变化规律。2. 掌握微粒半径变化规律及大小的比较。3. 通过第三周期元素的性质探究同周期元素性质的递变规律。4. 掌握金属性、非金属性的变化规律及比较方法。
通过元素周期律的学习培养学生论据推理与模型认知的化学核心素养,通过元素周期律变化本质的学习培养学生宏观辨识与微观探析的化学核心素养。
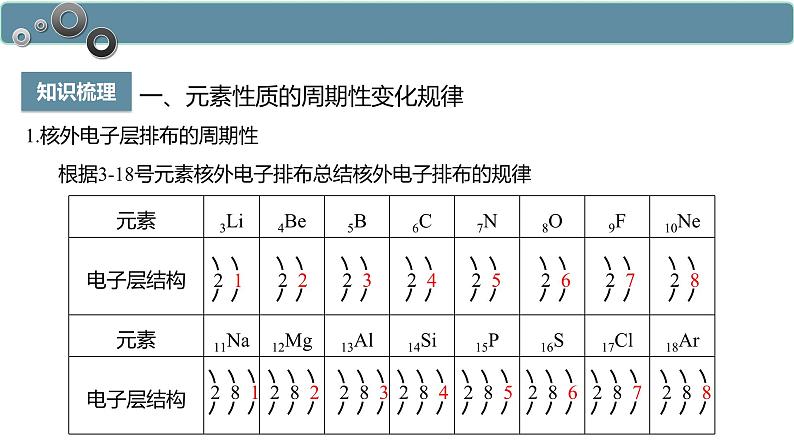
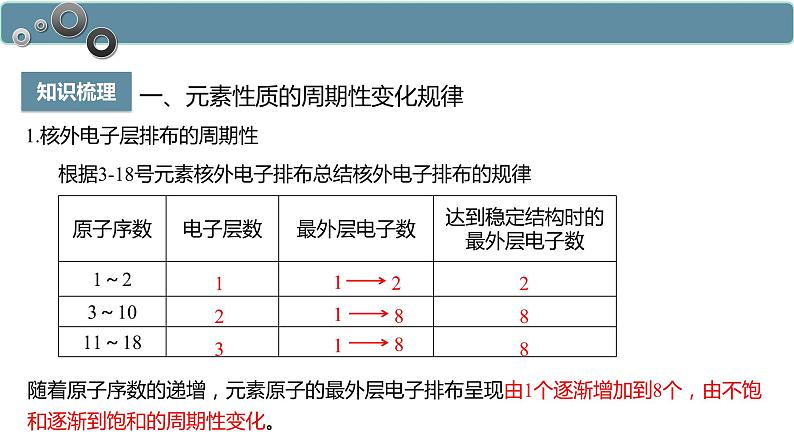
1.核外电子层排布的周期性
根据3-18号元素核外电子排布总结核外电子排布的规律
一、元素性质的周期性变化规律
随着原子序数的递增,元素原子的最外层电子排布呈现由1个逐渐增加到8个,由不饱和逐渐到饱和的周期性变化。
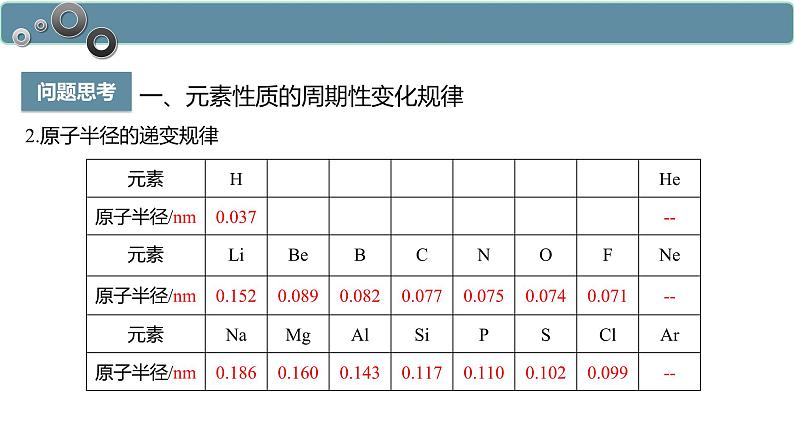
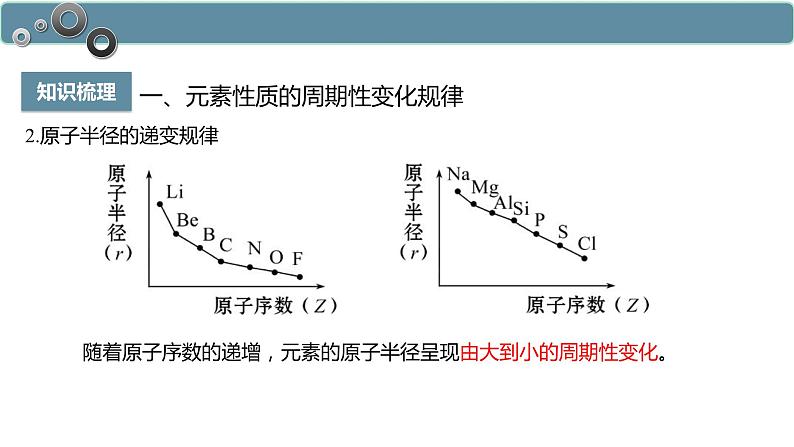
2.原子半径的递变规律
随着原子序数的递增,元素的原子半径呈现由大到小的周期性变化。
(2)同周期元素原子半径随原子序数增大逐渐减小的原因是什么?
(1)同主族元素原子半径随原子序数增大逐渐增大的原因是什么?
(3)试比较Na+和F-的半径大小:
r(Na+) r(F-)
(1)原子半径大小比较
从上到下:电子层数依次增加
从左到右:核电荷数依次增加,最外层电子数依次增加
(Ⅱ)同周期主族元素(零族除外)
----- 原子半径越来越大
---- 原子半径越来越小
(2)离子半径大小的比较
(Ⅲ)具有相同电子层结构的离子
从上到下:阴离子、阳离子半径逐渐增大
②从左到右:阴离子半径逐渐减小,阳离子半径逐渐减小
①同一元素阴离子半径大于阳离子半径
核电荷数越大,原子核对核外电子的吸引力越大,半径越小
10电子: 7N3- > 8O2- > 9F- >11Na+ > 12Mg2+ > 13Al3+
(3)同种元素的各种粒子半径大小比较
核外电子数越多,粒子半径越大。
Fe>Fe2+ > Fe3+
(4)不同周期、主族、电子层结构也不相同的粒子半径大小比较
比较半径:Na+ S2-
因 Na+< F-,S2- > Cl-, Cl- > F-,故 S2->Na+。
可选F-、Cl-来对比
Mg2+、Na+ 、 O2- 、N3-
K+、 Cl-、 S2-、Ca2+
比较下列粒子半径的大小:
(N3-> O2- > Na+> Mg2+)
( S2- > Cl- > K+ > Ca2+ )
( S2- > S )
(Al > Al3+)
3.化合价的周期性变化
同 一 周 期 变 化 规 律 是 什 么?
随着原子序数的递增,元素化合价呈现由低逐渐升高的周期性变化。
(2)化合价与主族序数的关系
(Ⅲ)︱最高正价︱+︱最低负价︱= 8
从上到下,化合价一般相同
从左到右,化合价一般由 +1→+7, 0 (-4→-1, 0)
(Ⅰ)金属无负价,氟元素、氧元素无正价
(Ⅰ)最高正价 = 最外层电子数 = 主族序数
(Ⅱ)最低负价 = – (8 – 最外层电子数)= – (8 – 主族序数)
(Ⅱ)稀有气体元素化学性质不活泼,通常情况下难 以与其他元素化合,规定其化合价为0
同周期元素原子结构和元素性质有何特点?二者有何联系?
最外层电子数少,容易失去
半径减小,失电子能力减弱
元 素 金 属 性 减 弱
最外层电子数多,容易得到
半径减小,得电子能力增强
元 素 非 金 属 性 增 强
4.同周期元素性质的递变规律
如何设计实验判断钠、镁、铝三种金属的金属性强弱?
试剂:镁条,金属钠,MgCl2溶液,氨水、盐酸,NaOH溶液,AlCl3溶液,蒸馏水。仪器:烧杯,试管,表面皿,酒精灯,试管夹。
研究物质化学性质的一般方法:
实验一:钠、镁与水反应的对比
结论:金属性强弱 Na>Mg
2Na + 2H2O == 2NaOH + H2↑
AlCl3+3NH3·H2O=Al(OH)3 ↓+3NH4Cl
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+3H+ =Al3+ +3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3是两性氢氧化物
MgCl2+2NH3·H2O= Mg(OH)2 ↓+2NH4Cl
Mg(OH)2 +2HCl=MgCl2+2H2O
Mg(OH)2 +2H+ =Mg2+ +2H2O
Mg(OH)2不溶于强碱,属于中强碱
Na Mg Al
金属性逐渐减弱
最高价氧化物对应水化物的酸碱性
1.元素性质的周期性变化
随原子序数的递增:(1)元素原子的核外电子排布呈现周期性变化(2)元素原子半径呈现周期性变化(3)元素主要化合价呈现周期性变化(4)元素的金属性、非金属性呈现周期性变化
元素的性质随着元素原子序数的递增而呈现周期性的变化 —— 元素周期律
元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果
3. 元素周期律的实质
1.下列各组元素的性质递变规律错误的是( )
A.N、O、F原子最外层电子数依次增加B.N、O、F原子半径依次增大C.Na、Mg、Al元素最高正化合价依次升高D.Li、Na、K的金属性依次增强
A.Na、Mg、Al最外层电子数依次增多,其单核离子的氧化性依次增强B.P、S、Cl最高正化合价依次升高,对应简单气态氢化物的稳定性依次增强C.同周期元素的原子半径以第ⅦA族最大D.Na、Mg、Al的氢氧化物的碱性依次减弱
2.下列关于元素周期律的叙述中不正确的是( )
A.原子半径:丙<丁<戊B.金属性:甲>丙C.氢氧化物碱性:丙>丁>戊D.最外层电子数:甲>乙
3.短周期金属元素甲~戊在元素周期表中的相对位置如下表所示,下列判断正确的是( )
元 素 金 属 性 减 弱
元 素 金 属 性 减 弱
元 素 金 属 性 减弱
随着原子序数的递增,元素的金属性和非金属性呈现周期性变化
同一周期从左往右,金属性逐渐减弱,非金属性逐渐增强
同一主族从上到下,金属性逐渐增强,非金属性逐渐减弱
必修 第一册第二节 元素周期律多媒体教学ppt课件: 这是一份必修 第一册<a href="/hx/tb_c161998_t3/?tag_id=26" target="_blank">第二节 元素周期律多媒体教学ppt课件</a>,共25页。PPT课件主要包含了考纲要求,由1到8,逐渐减小,依次减弱,两性氢氧化物,中强酸,依次增强,三元素周期律,3实验比较法等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 元素周期律教学ppt课件: 这是一份人教版 (2019)必修 第一册第二节 元素周期律教学ppt课件,共33页。PPT课件主要包含了素养要求,元素性质的递变规律,当堂练习等内容,欢迎下载使用。
高中化学第一节 原子结构与元素周期表教学ppt课件: 这是一份高中化学第一节 原子结构与元素周期表教学ppt课件,共20页。PPT课件主要包含了镓的故事,学习目标,核外电子排布的规律等内容,欢迎下载使用。













