

高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物当堂达标检测题
展开一、单选题
1.在下列溶液中加盐酸,仍能大量共存的一组离子是
A.、、、B.、、、
C.、、、D.、、、
2.进行钠与水反应的实验时,完全不需用到的个人安全防护用品是
A.防毒面具B.橡胶手套C.护目镜D.实验服
3.只用一种试剂即可区别、、三种溶液,该试剂是
A.溶液B.溶液C.溶液D.溶液
4.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.能使酚酞变红的溶液中:Ba2+、Mg2+、NO3-、Cl-
B.=1012的溶液:K+、Na+、AlO2-、SO42-
C.加入苯酚显紫色的溶液中:K+、Mg2+、SCN-、NO3-
D.由水电离出的c(H+)=1×10-13的溶液:Na+、NH4+、ClO-、CO32-
5.某白色固体混合物由Na2SO4、CaCl2、MgCl2、K2CO3中的两种组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②向溶液中加碱,产生白色沉淀;③向溶液中加入BaCl2无明现象。根据实验现象可判断其组成为
A.Na2SO4、CaCl2B.CaCl2、MgCl2C.MgCl2、K2CO3D.Na2SO4、K2CO3
6.下列四组溶液中,不用其他试剂即可全部鉴别的是
①CuSO4、Na2SO4、BaCl2 ②Na2CO3、BaCl2、H2SO4
③HCl、NaOH、Na2SO4 ④Ca(OH)2、NaCl、BaCl2
A.①②B.②③C.①③④D.①②④
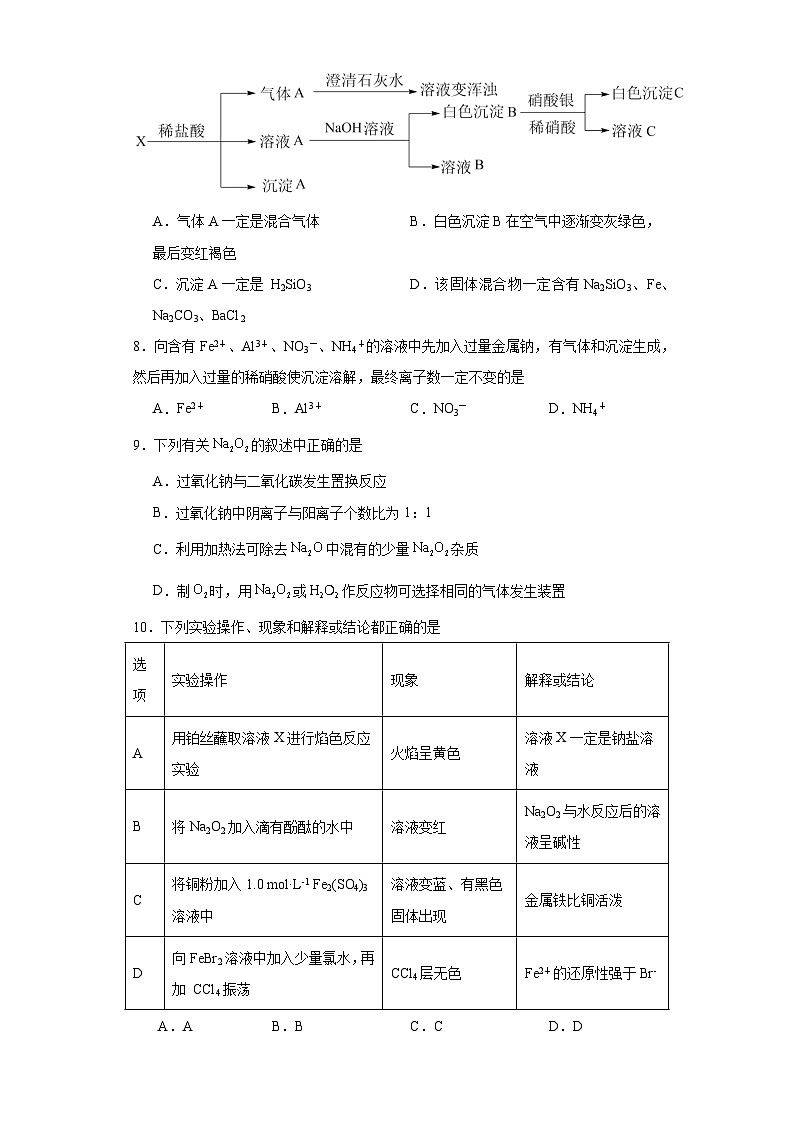
7.某固体混合物X可能是由Na2SiO3、Fe、Na2CO3、BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计实验方案如图所示所加试剂均过量。下列说法不正确的是
A.气体A一定是混合气体B.白色沉淀B在空气中逐渐变灰绿色,最后变红褐色
C.沉淀A一定是 H2SiO3D.该固体混合物一定含有Na2SiO3、Fe、Na2CO3、BaCl2
8.向含有Fe2+、Al3+、NO3-、NH4+的溶液中先加入过量金属钠,有气体和沉淀生成,然后再加入过量的稀硝酸使沉淀溶解,最终离子数一定不变的是
A.Fe2+B.Al3+C.NO3-D.NH4+
9.下列有关的叙述中正确的是
A.过氧化钠与二氧化碳发生置换反应
B.过氧化钠中阴离子与阳离子个数比为1:1
C.利用加热法可除去中混有的少量杂质
D.制时,用或作反应物可选择相同的气体发生装置
10.下列实验操作、现象和解释或结论都正确的是
A.AB.BC.CD.D
二、填空题
11.向CuSO4溶液中加入过量NaOH溶液,反应的离子方程式为: ,向其混合液中再加入HCl,反应的离子方程式为: 。
12.实验室里,某同学取一小块金属钠做实验。完成下列问题:
(1)将钠放入水中的化学方程式 。
(2)钠投入水中后,熔化成一个小球,根据这一现象你能得出的结论是 。
(3)将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是 (填字母)。
A.有气体生成
B.钠熔化成小球并在液面上游动
C.溶液底部有银白色的金属钙生成
D.溶液变浑浊
E.滴加酚酞后溶液变红
(4)下列有水参与的反应中,H2O只做氧化剂的有 (填字母,下同),H2O只做还原剂的有 ,H2O既做氧化剂又做还原剂的有 。
A.电解水 B.Na+H2O C.Na2O+H2O D.Na2O2+H2O E.Cl2+H2O F.2F2+2H2O=4HF+O2 G.CO2+H2O
13.氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如图:
加入NaClO3饱和溶液后发生反应的化学方程式为 。
14.酸与碱的中和反应在生活生产中有重要的应用。下图从不同角度反映稀硫酸和氢氧化钠溶液的反应。
请回答下列问题:
(1)图甲,烧杯中盛有氢氧化钠溶液,滴入2~3滴酚酞溶液,现象是 ,变色的原因是溶液的pH 7(填写大于、等于或小于)。
(2)向稀硫酸中滴加氢氧化钠溶液,得到溶液pH与加入氢氧化钠溶液质量的关系如图乙。
①当加入ag氢氧化钠溶液时,此时溶液中的溶质是 (填写化学式)。
②当加入氢氧化钠溶液的质量正好反应到M点时,溶液中的主要离子及其比值是 (填写符号和比值)。
③当加入氢氧化钠溶液的质量为bg时,所得溶液中的pH 7(填写大于、等于或小于)。
(3)在溶液中硫酸氢钠(NaHSO4)完全解离出Na+、H+、SO,其溶液呈酸性。
①向硫酸氢钠溶液中滴加氢氧化钠溶液,完全反应的化学方程式是 。
②向硫酸氢钠溶液中滴加氢氧化钡溶液反应至溶液呈中性,写出反应的化学方程式 。
15.除去下列物质中所混有的少量杂质,括号内为杂质。指明应加入的试剂,写出有关方程式。
(1)Fe粉(Al粉):试剂 离子方程式 ;
(2)FeCl2溶液(FeCl3):试剂 离子方程式 ;
(3)Na2CO3固体(NaHCO3):化学方程式 。
16.应用连线
、 、 、 、
17.现有中学化学中常见的一些物质:①Ba(OH)2溶液②乙醇③熔融NaCl④干冰⑤NaHSO4固体⑥稀硫酸⑦Na
(1)上述物质中能够导电的是 ,(填物质序号,下同)属于混合物的是 ,属于盐的是 ,其水溶液能够使石蕊变红的有 ,属于电解质的是 。
(2)写出NaHSO4在水溶液中的电离方程式 。
(3)写出①与⑥反应的离子反应方程式 。
(4)写出⑦与水反应的化学方程式: 。
18.某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)写出步骤Ⅰ反应的离子方程式: ; 。
(2)试剂X是 。由溶液D是 。
(3)在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。
一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
(4)溶液E中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因 。
(5)用固体F继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;写出反应的化学方程式
(6)工业上常用溶液E经进一步处理可制得净水剂Na2FeO4,流程如下:
①测得溶液E中c(Fe2+) 为0.2 ml·L-1,若要处理1 m3溶液E,理论上需要消耗25 % 的H2O2溶液 kg。
②写出由Fe(OH)3制取Na2FeO4的离子方程式 。
19.无机化合物可根据其组成和性质进行分类:
(1)上述所示的物质分类方法名称是 .
(2)①CO2 ②Cu ③FeCl3溶液 ④H2SO4 ⑤氢氧化铁体胶体 ⑥Al2(SO4)3固体 ⑦酒精 ⑧BaSO4固体
属于电解质的是 ;属于非电解质的是 (填序号)。
(3)请写出⑥的电离方程式
(4)下列关于③和⑤的说法正确的是 。
a.都不稳定,密封静置会产生沉淀
b.⑤能产生丁达尔效应,而③不能
c.加入盐酸都会产生沉淀
(5)按要求写出下列反应的离子方程式:
①锌跟稀硫酸反应 。
②氢氧化钡溶液和稀硫酸反应 。
③MgO滴加稀盐酸 。
20.表中是常见的物质,根据要求完成空格
(1)在生活中有重要用途,可作食品加工中的 ,将其固体加热可得到上述物质中的另一种盐,写出反应的方程式 。
(2)上述物质的类别有一项错误的是 (写序号),熔融状态可以导电的电解质有 种,属于非电解质的是 (写序号)。
(3)证明MgO是碱性氧化物可以与上述物质中的酸反应,写出化学方程式 。
(4)写出在水中的电离方程式 。
三、实验题
21.木材的深加工能有效提高其经济效益。工业上将木材进行干馏隔绝空气加强热可得到木煤气含、、等、木焦油、焦木酸木炭等产品。
请回答下列问题:
(1)木炭中一定含有 元素
(2)下列装置可对木柴干馏后的产品进一步加工。
①用装置可除去木煤气中的少量,混合器应从 口通入填仪器口字母,广口瓶中所盛试剂是 ,有关反应的离子方程式是 。
②木焦油和焦木酸中含有苯、乙酸和甲醛等,他们的部分性质如表所示。
若从苯、乙酸和甲醇的混合液中将三者一一分离,可选用上述装置中的 填装置序号,盛装混合液的仪器名称是 ,该试验的原理是利用了三种物质的 不同。实验时冷凝水的进水口是 填仪器口字母。为保证实验安全,还需要注意的一项操作是 。
22.电子工业上常用氯化铁溶液做印刷电路铜板的腐蚀液,使用过的腐蚀废液中的金属离子主要有、和。化学兴趣小组设计如下流程对废液进行处理并回收氯化铁溶液。
(1)步骤(Ⅰ)中加入溶液的目的是将 (填“氧化”或“还原”)成;取少量溶液A于试管中,滴入1~2滴KSCN溶液,溶液显 (填“红色”或“蓝色”)。
(2)步骤(Ⅱ)中分离溶液B和沉淀的操作名称是 ;所需用到的玻璃仪器有烧杯、普通漏斗和 。滤液B中的阳离子除了外,主要还有 ;
(3)写出步骤(Ⅲ)中与稀盐酸反应的离子方程式: ;
23.某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒金属钠,再从U形管左端加入水 (含有酚酞),赶出空气,一段时间后加热铜丝。根据反应中观察到的现象,回答下列问题:
(1)钠与水反应的离子方程式为 。
(2)金属钠的变化现象是 。
(3)U形管中溶液的颜色变化: ,说明有 生成。
(4)铜丝的变化现象是 ,说明有 生成。
选项
实验操作
现象
解释或结论
A
用铂丝蘸取溶液X进行焰色反应实验
火焰呈黄色
溶液X一定是钠盐溶液
B
将Na2O2加入滴有酚酞的水中
溶液变红
Na2O2与水反应后的溶液呈碱性
C
将铜粉加入1.0 ml·L-1 Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
D
向FeBr2溶液中加入少量氯水,再加 CCl4振荡
CCl4层无色
Fe2+的还原性强于Br-
物质及其用途的连线
物质
A.稀硫酸
B.氧化铁
C.过氧化钠
D.二氧化硫
E.碳酸氢钠
F.亚铁盐
用途
a. 生产硫酸
b.除铁锈
c.作红色颜料
d.作供氧剂
e. 作膨松剂
f. 作补铁剂
物质
①
②
③
④
类别
盐
酸
氧化物
单质
物质
⑤
⑥
⑦MgO
⑧
类别
盐
碱
氧化物
酸
物质
熔点
沸点
密度
溶解性
苯
不溶于水
乙酸
两者互溶且均易溶于水
甲醇
参考答案:
1.B
2.A
3.A
4.B
5.B
6.A
7.D
8.B
9.D
10.D
11. Cu2++2OH-=Cu(OH)2↓ Cu(OH)2+2H+=Cu2++2H2O,OH-+H+=H2O
12.(1)2Na+2H2O=2NaOH+ H2↑
(2)钠与水反应放出热量,钠的熔点低
(3)C
(4) B F A
13.MgCl2+2NaClO3=Mg(ClO3)2↓+2NaCl
14.(1) 溶液由无色变红色 大于
(2) Na2SO4、H2SO4 Na+:SO=2:1 大于
(3) NaHSO4+NaOH=Na2SO4 +H2O 2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O
15. NaOH 2Al+2OH-+2H2O=2AlO2-+3H2↑ Fe Fe+2Fe3 +=3Fe2+ 2NaHCO3Na2CO3+H2O+CO2↑
16. B-c C-d D-a E-e F-f
17.(1) ①③⑥⑦ ①⑥ ③⑤ ④⑤⑥ ③⑤
(2)NaHSO4=Na++H++
(3)Ba2++2OH-+2H++=BaSO4+2H2O
(4)2Na+2H2O=2NaOH+H2↑
18. 2Al+2H2O+2OH-=2AlO+3H2↑ Al2O3+2OH-=2AlO+H2O 稀硫酸 NaHCO3 a,b间加一个盛有饱和NaHCO3的洗气瓶,除去HCl 2Fe3++Fe=3Fe2+ 2Cu+O2+ 2H2SO42CuSO4+2H2O 13.6kg 2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O
19. 树状分类法 ④⑥⑧ ①⑦ Al2(SO4)3 = 2Al3+ + 3SO42- b Zn+2H+=Zn2++H2↑ Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O MgO+2H+=Mg2++H2O
20.(1) 膨松剂
(2) ⑧ 5 ③
(3)
(4)
21.(1)C、、O
(2) b NaOH溶液 Ⅱ 蒸馏烧瓶 沸点 f 加入沸石或碎瓷片
22.(1) 氧化 红色
(2) 过滤 玻璃棒
(3)
23.(1)2Na+2H2O=2NaOH+H2↑
(2)熔成银白色小球,在水和煤油的界面上作上下跳动且逐渐变小
(3) 变为红色 NaOH
(4) 由黑色变红色 氢气
化学必修 第一册第二单元 金属钠及钠的化合物课后测评: 这是一份化学必修 第一册第二单元 金属钠及钠的化合物课后测评,共21页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物课时练习: 这是一份苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物课时练习,共16页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物同步测试题: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物同步测试题,共20页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。













