



苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物优质课件ppt
展开1.理解强电解质和弱电解质的概念,能用电离方程式表示电解质的电离。2.了解离子反应和离子方程式的含义,掌握离子方程式的书写步骤和方法,能判断离子方程式的正误。
为什么电解水要加少量稀硫酸?
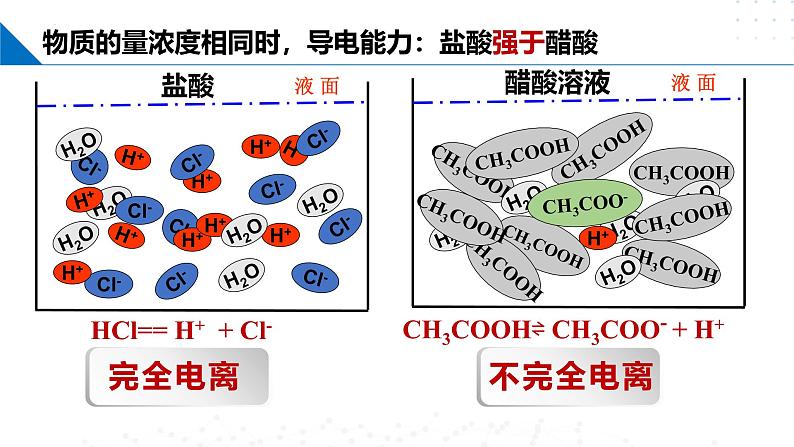
物质的量浓度相同的不同电解质溶液,其导电能力是否相同呢?
物质的量浓度相同时,导电能力:盐酸强于醋酸
HCl== H+ + Cl-
CH3COOH⇌ CH3COO- + H+
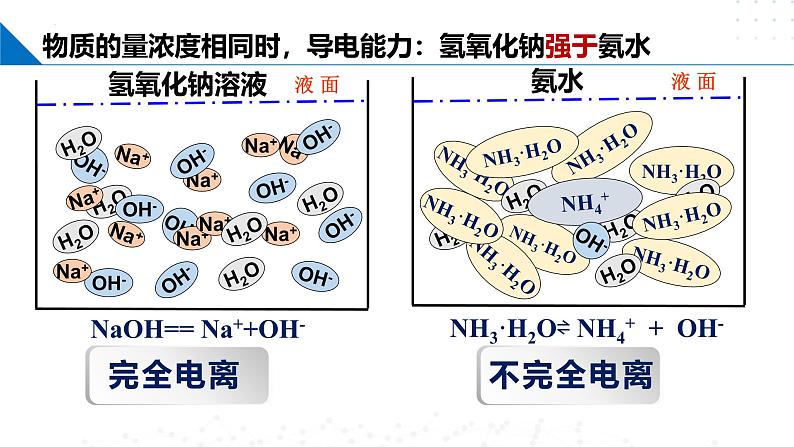
物质的量浓度相同时,导电能力:氢氧化钠强于氨水
NaOH== Na++OH-
NH3·H2O⇌ NH4+ + OH-
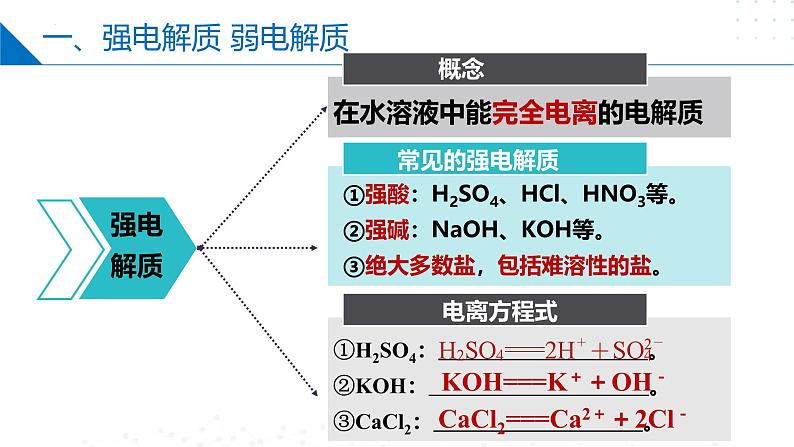
在水溶液中能完全电离的电解质
①强酸:H2SO4、HCl、HNO3等。②强碱:NaOH、KOH等。③绝大多数盐,包括难溶性的盐。
①H2SO4: 。②KOH: 。③CaCl2: 。
KOH===K++OH-
CaCl2===Ca2++2Cl-
一、强电解质 弱电解质
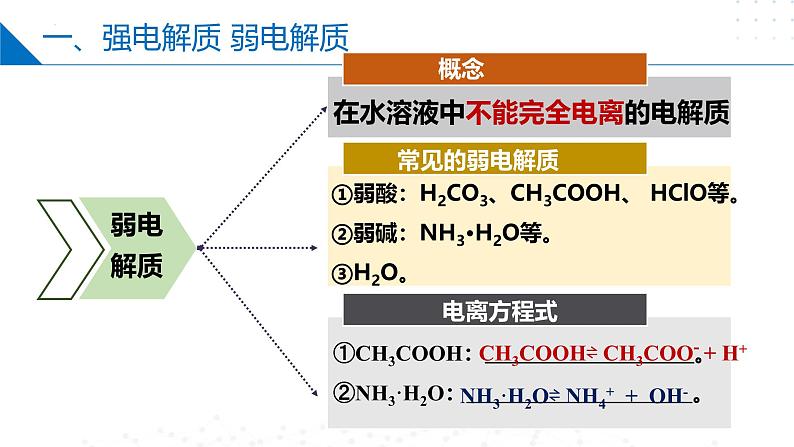
在水溶液中不能完全电离的电解质
①弱酸:H2CO3、CH3COOH、 HClO等。②弱碱:NH3·H2O等。③H2O。
①CH3COOH: 。②NH3·H2O: 。
强电解质和弱电解质的比较
多数盐(包括难溶盐)、强酸、强碱等
只有阴、阳离子、溶剂分子
既有阴、阳离子、溶剂分子,还存在电解质分子
1、BaSO4溶液的导电性很弱,是因为BaSO4为弱电解质。2、强电解质在液态时,有的导电,有的可能不导电。3、强电解质溶液一定比弱电解质溶液导电性强。
错。BaSO4溶于水的部分完全电离,在熔融状态也是完全电离的。
对。如BaSO4在液态(熔融状态)时能导电,但硫酸在液态时不导电。
错。导电能力强弱与溶质离子浓度及多带电荷有关。
例1.现有以下物质:①NaCl溶液;②液态SO3;③乙醇(C2H5OH);④熔融的KNO3;⑤BaSO4固体;⑥干冰;⑦铜;⑧醋酸;⑨HCl气体;⑩氨气。请回答下列问题(用序号填写):(1)能导电的是 。 (2)属于电解质的是 。(3)属于非电解质的是 。 (4)属于强电解质的是 。(5)属于弱电解质的是 。
Na2CO3溶液分别与澄清石灰水、CaCl2溶液反应,都有白色的CaCO3沉淀生成,这两个反应的实质是否相同?
Ca2+、CO32-结合成CaCO3沉淀
有离子参加的化学反应称为离子反应
从微观角度,酸、碱、盐在水溶液中发生的复分解反应,实质上是电解质在溶液中相互交换离子的反应。
离子反应使溶液中某些离子的浓度减小。
生成难溶物质(如:沉淀)
生成挥发性物质(如:气体)
生成难电离物质(如:弱电解质)
Na2CO3 + CaCl2 =2 NaCl + CaCO3↓
Na2CO3+Ca(OH)2=2NaOH +CaCO3↓
CO3 2- + Ca2+ =CaCO3↓
CO3 2- + Ca2+=CaCO3↓
(以碳酸钠与盐酸的反应为例)
Na2CO3 + 2HCl ═2 NaCl + CO2↑+H2O
2Na++CO32- + 2H++2Cl- ═2 Na+ +2Cl- + CO2↑+H2O
CO32- + 2H+ ═ CO2↑+ H2O
离子反应中“拆”的标准:
溶于水且完全电离的物质
需要用化学式表示的物质
BaSO4 、 BaCO3、CaCO3、AgCl等Al(OH)3 、Mg(OH)2 、 Fe(OH)3等
弱酸(CH3COOH 、 HClO 、 HF等)弱碱(NH3.H2O)、 水
HCl+NaOH===NaCl+H2O
HCl+KOH===KCl+H2O
H++OH-===H2O
H2SO4+2NaOH===Na2SO4+2H2O
例2、书写下列反应的离子方程式(1)氧化镁溶于稀盐酸。(2)用碳酸钙与稀盐酸反应制备二氧化碳。(3)铁与稀硫酸反应生成氢气。
MgO+2H+===Mg2++H2O
CaCO3+2H+===Ca2++CO2↑+H2O
Fe+2H+===Fe2++H2↑
(4)二氧化碳与澄清石灰水反应生成沉淀。(5)氢氧化铜溶于稀硫酸。
Ca2++2OH-+CO2===CaCO3↓+H2O
Cu(OH)2+2H+===Cu2++2H2O
1.看是否符合客观事实书写离子方程式时,离子反应必须符合客观事实,不可主观臆造离子反应或产物。例如,铁与稀硫酸的反应:2Fe+6H+===2Fe3++3H2↑(×),因为Fe与稀硫酸反应生成Fe2+,不会生成Fe3+。
“六看法”巧解离子方程式的正误判断题
2.看化学式拆分是否合理易溶于水且完全电离的电解质用离子符号表示,如强酸(HCl、H2SO4、HNO3等)、强碱[NaOH、KOH、Ba(OH)2等]及可溶性盐。弱酸、弱碱、难溶性物质、单质、氧化物、气体等用化学式表示。例如,碳酸钙与醋酸的反应:CaCO3+2H+===Ca2++CO2↑+H2O(×),因为醋酸是弱酸,要用化学式CH3COOH表示。3.看是否遵循原子守恒和电荷守恒离子方程式要符合原子守恒和电荷守恒规律。例如,Al和稀盐酸的反应:Al+2H+===Al3++H2↑(×),因为不符合电荷守恒规律。
6.看是否忽视“量变”对反应及产物的影响书写离子方程式时,“少量”“过量”“适量”等不同情况,产物可能不同。例如,澄清石灰水中通入过量CO2的反应:Ca2++2OH-+CO2=== CaCO3↓+H2O(×),因为澄清石灰水与过量的CO2反应生成Ca(HCO3)2。
例3、下表中对离子方程式的评价不合理的是( )
如对于含有硫酸钠的粗盐,加水溶解后先加入氯化钡溶液,再加入稍过量的碳酸钠溶液,过滤;向滤液中加入稍过量的盐酸,蒸发结晶获得精盐。
一般是依据题目表述的实验试剂、实验现象,再结合离子的性质,初步推出可能的离子,然后根据离子反应条件、离子是否共存等理论进行分析,从而得出正确结论。
利用物质间发生不同的离子反应,由加入相关试剂时反应产生的不同现象予以鉴别。
在溶液中,若离子之间不发生反应,则离子可以大量共存;若离子之间能发生反应,则不能大量共存。
(1).看题目的具体要求看题目中要求选择“能大量共存”“不能大量共存”“一定大量共存”还是“可能大量共存”的离子组。
概念常见物质电离方程式
发生条件离子方程式书写离子方程式正误判断
高中化学第二节 离子反应评优课备课课件ppt: 这是一份高中化学<a href="/hx/tb_c161973_t3/?tag_id=26" target="_blank">第二节 离子反应评优课备课课件ppt</a>,共25页。PPT课件主要包含了离子共存,离子方程式正误判断,离子检验,本节重点,本节难点,离子推断,离子共存问题审题技巧,生成水,生成气体NH3,生成弱酸醋酸等内容,欢迎下载使用。
苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物示范课课件ppt: 这是一份苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物示范课课件ppt,共16页。PPT课件主要包含了复习旧知,导电性实验等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物优秀课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物优秀课件ppt,共18页。PPT课件主要包含了学习目标,课程导入,学习探究,灯很亮,灯稍暗,弱酸水,强碱强酸,某些共价化合物,水合离子,离子反应等内容,欢迎下载使用。













