





还剩44页未读,
继续阅读
所属成套资源:高一化学同步精品课件(苏教版2019必修第一册)
成套系列资料,整套一键下载
专题4 第1单元 课题2 硫酸的工业制备 浓硫酸的性质 高一化学同步精品课件(苏教版2019必修第一册)
展开
这是一份专题4 第1单元 课题2 硫酸的工业制备 浓硫酸的性质 高一化学同步精品课件(苏教版2019必修第一册),共52页。
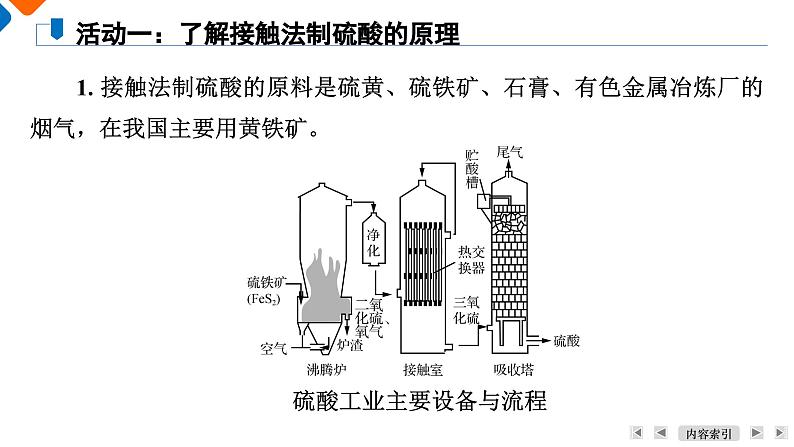
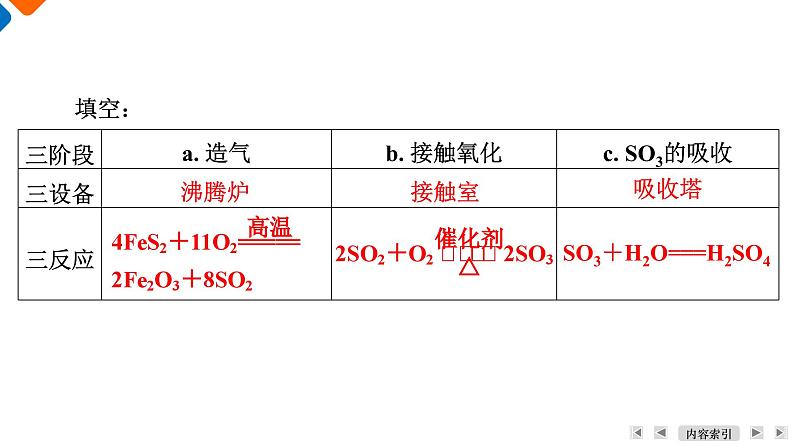
学 习 目 标1. 了解硫酸的工业制法。2. 了解硫酸的酸性、浓硫酸的特性。活 动 方 案1. 接触法制硫酸的原料是硫黄、硫铁矿、石膏、有色金属冶炼厂的烟气,在我国主要用黄铁矿。硫酸工业主要设备与流程活动一:了解接触法制硫酸的原理填空:沸腾炉接触室吸收塔SO3+H2O===H2SO42. 尾气的吸收。通常工业上是用氨水来吸收SO2,其反应的化学方程式为_____________________________________________、______________________________________________。SO2+2NH3·H2O===(NH4)2SO3+H2O(NH4)2SO3+SO2+H2O===2NH4HSO33. 工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔;仿照工业上制备硫酸的流程设计出下面的装置,以探究有关问题。请回答下列问题:(1) 写出FeS2与氧气反应的化学方程式:_________________________________________。(2) 从乙装置中出来的气体有________________________。(3) 写出上图丙装置的作用:________________________________。(4) 本实验增加丁装置的目的是_______________________________________________________________________。(5) 本实验设计还存在的较明显缺陷是____________________。8SO2SO2、O2、SO3吸收SO3气体(模拟吸收塔)探究工业上为何采用98.3%的浓硫酸吸收三氧化硫而不用水(吸收产生酸雾)缺少尾气吸收装置化学工业制备的要求:1. 原料廉价且稳定,最好能结合本地地理环境的优势资源,以降低运输成本。2. 从环保、成本等角度选择合适的化学反应,设计合理的反应装置,对原料进行粉碎等预处理,使得原料尽可能地被富集,保证在反应中能充分接触。3. 制备流程简单高效,能耗低,反应放出的热量和剩余物质尽可能加以循环利用,生成的副产物较少。4. 制备过程绿色环保,没有使用或生成对环境有害的物质,若有,须对有害物质进行无害化处理。由于工业战略发展的需要,某地区打算建厂制备硫酸,项目负责人员正在考虑采用硫黄制酸还是硫铁矿制酸。如果你是负责人,你会收集哪些资料作为依据进行选择?【答案】 硫铁矿中FeS2的质量分数一般为20%~50%,制酸工艺过程中所产生的矿渣和废气使生产装置变得较为复杂。而采用硫黄制酸法,工艺流程和设备相对简易。硫黄含杂质少,燃烧生成的气体含杂质少,可免去气体净化的过程,制备过程也不产生矿渣。因此,硫铁矿制酸设备投资几乎是同等规模硫黄制酸设备的两倍。但硫黄原料价格高于硫铁矿,具体选用何种硫酸制工艺,应根据实际条件和要求进行决策。1. 以稀硫酸为例,用电离方程式或离子方程式表示下列酸的通性:(1) 与指示剂作用。 (2) 与活泼金属反应放出氢气。【答案】 Zn+2H+===Zn2++H2↑(3) 与金属氧化物反应生成盐和水。【答案】 CuO+2H+===Cu2++H2O(4) 与碱反应生成盐和水。【答案】 Cu(OH)2+2H+===Cu2++2H2O活动二:认识稀硫酸具有酸的通性(5) 与盐反应生成新盐和新酸。【答案】 MgCO3+2H+===Mg2++H2O+CO2↑2. 工业上常用硫酸跟磷酸钙[Ca3(PO4)2]反应制取磷酸。该方法应用了什么化学原理?【答案】 强酸制弱酸原理。1. 探究浓硫酸的吸水性与脱水性活动三:探究浓硫酸的特性蓝色晶体逐渐变成灰白色浓硫酸有吸水性片刻后纸片发黄变黑并被蚀穿浓硫酸有脱水性试纸变红,但片刻后试纸变黑并被蚀穿浓硫酸有酸性、脱水性开始时烧杯中蔗糖变棕色,然后快速膨胀变成黑色疏松多孔的固体,同时产生大量水蒸气并放出有刺激性气味的气体浓硫酸有脱水性、吸水性和强氧化性(1) 实验Ⅳ过程中反应过程如下图所示。①黑色物质急剧膨胀,长成黑色面包的原因是什么?【答案】 蔗糖炭化后,C与浓硫酸反应产生大量的气体,从而使黑色物质急剧膨胀,长成黑色面包。②蔗糖变黑体现了浓硫酸的什么性质?【答案】 表现了浓硫酸的脱水性和强氧化性。(2) 浓硫酸吸水性和脱水性的有什么区别?由此看出:二者的根本区别在于物质本身是否存在水分子。(3) 浓硫酸常用作气体干燥剂,体现了浓硫酸的什么性质?【答案】 吸水性2. 探究浓硫酸的强氧化性。完成下表中的实验探究,观察现象,并说明该实验体现了浓硫酸的何种性质(酸性、吸水性、脱水性和强氧化性等)。将你所得的结论写出来。在试管底部有灰白色固体出现,加入水中后形成蓝色溶液;放出的气体能使品红褪色浓硫酸有酸性和强氧化性无明显现象浓硫酸有强氧化性,在常温下使铁、铝发生了钝化(1) 实验Ⅴ还可以采用下图装置进行实验①写出该反应的化学方程式。②可拉动的铜丝代替铜片的优点是什么?【答案】 可以拉动铜丝控制反应的进行与停止。③试管c中“浸有NaOH溶液的棉团”的作用是什么?写出反应的化学方程式。【答案】 吸收多余的SO2,以防污染环境,SO2+2NaOH=== Na2SO3+H2O。④将64 g铜片加入盛有浓硫酸(含2 mol H2SO4)的试管中加热,充分反应后,铜片能否完全溶解?请解释原因。【答案】 铜片不能完全溶解,原因是随着反应的进行,硫酸的浓度变小,而铜与稀硫酸不反应。⑤浓硫酸与过量的Zn充分反应,发生的反应有哪些?写出化学方程式。【答案】 Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O,Zn+H2SO4(稀)===ZnSO4+H2↑。 (2) Fe、Al的钝化。常温下,当Fe、Al遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。①“钝化”是化学变化吗?【答案】 是化学变化,金属表面生成致密的氧化物,有新物质生成。②常温下应如何储运浓硫酸?【答案】 常温下,浓硫酸能使Fe、Al“钝化”,故可用铝槽(或铁罐)车储运浓硫酸。(3) 与非金属反应加热时,浓硫酸可以和C、S、P等非金属反应,写出浓硫酸与木炭反应的化学方程式。1. 鉴别稀硫酸与浓硫酸。在两个容器中盛有相同体积的浓硫酸和稀硫酸,设计简单的方法将其中的浓硫酸挑出来。看看谁设计的方法多?谁设计的方法简单?谁设计的方法最有创意?【答案】 (1) 密度法:用密度计测量两者的密度,密度大的为浓硫酸。(2) 稀释法:分别取少量两种浓度的硫酸加入一定量水中,放出热量大的为浓硫酸。活动四:浓硫酸、稀硫酸的鉴别,利用废铜屑制备硫酸铜溶液(3) 吸水法:用试管分别取少量,再加入少量胆矾,能使胆矾变灰白的为浓硫酸。(4) 脱水法:用玻璃棒分别蘸取少量液体涂在纸片上,能使纸片变黑的为浓硫酸。(5) 强氧化性:用试管分别取少量两种浓度的硫酸,再加入少量铜片,加热后能和铜片反应的为浓硫酸。(6) 利用黏稠性:轻轻振荡两份溶液,观察液体的黏稠性,黏稠性大的为浓硫酸。2. 利用废铜屑制备硫酸铜溶液。某课外兴趣小组利用废铜屑制备硫酸铜溶液,设计了下列几种实验方案:方案一:以废铜屑和浓硫酸反应制取硫酸铜溶液。方案二:将废铜屑在空气中灼烧后,再投入稀硫酸中可制得硫酸铜溶液。方案三:将废铜屑加入稀硫酸与双氧水的混合液中,并用30~40 ℃水浴加热,一段时间后,铜完全溶解,得到硫酸铜溶液。其实验流程如下:(1) 方案二与方案一相比,具有哪些优点?【答案】 制取等量的硫酸铜更加节省硫酸,且没有SO2等有害气体产生。(2) ①写出方案三的溶解过程中发生反应的离子方程式。②猜想该实验采用30~40 ℃水浴加热的原因是什么?【答案】 H2O2受热易分解。活动五:认识常见的硫酸盐课 堂 反 馈245137968101. 浓硫酸与下列物质作用时,只表现强氧化性的是( )A. 红热木炭 B. 木材炭化 C. 蓝色硫酸铜晶体 D. 氧化铜【答案】 A245137968102. 工业上采用接触法制硫酸,其中在接触室进行的反应是( )24513796810【解析】 工业接触法制硫酸时,硫铁矿或硫黄在沸腾炉灼烧来制取二氧化硫气体,A、B错误;二氧化硫和氧气在接触室中发生催化氧化来制备三氧化硫,C正确;三氧化硫在吸收塔中被98.3%的浓硫酸吸收制取发烟硫酸,D错误。【答案】 C24537968103. 浓硫酸有许多重要的性质,与含有水分的蔗糖作用过程中不能显示的性质是( )A. 吸水性 B. 脱水性C. 强氧化性 D. 酸性【答案】 D124537968104. 在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环。下列说法不正确的是( )A. 从①处通入SO3,整个吸收操作采取逆流的形式B. 从②处喷下98.3%的浓硫酸,瓷环的作用是增大接触面积C. 从③处导出的气体只含有少量SO2,可直接排入大气D. 从④处流出的是可用水或稀硫酸稀释的浓硫酸124537968101【解析】 三氧化硫的吸收通常使用98.3%的浓硫酸,不用水或稀硫酸,原因是水或稀硫酸吸收三氧化硫时容易形成酸雾,吸收效率低,不利于三氧化硫的吸收;气体的吸收常采用逆流原理,这样有利于气、液的充分接触,吸收效果好;从吸收塔上部导出的气体是没有起反应的O2和少量二氧化硫,直接排入大气会污染环境,所以应用吸收剂吸收或循环使用。【答案】 C阅读下列材料,完成5~7题。硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料和盐类。我国工业上一般以黄铁矿为原料来制备硫酸。工业制硫酸涉及下列反应:24537968105. (2023·南通期末)下列有关硫及其化合物的性质与用途具有对应关系的是( )A. 硫具有还原性,可用硫黄处理洒落的汞单质B. 二氧化硫具有氧化性,可用作葡萄酒的抗氧化剂C. 稀硫酸具有酸性,可用于去除铁锈D. 浓硫酸具有脱水性,可用于干燥二氧化硫124537968101【解析】 Hg+S===HgS,硫的化合价降低,体现氧化性,A错误;SO2具有还原性,作抗氧化剂,B错误;稀硫酸除铁锈的离子反应为Fe2O3+6H+===2Fe3++3H2O,体现酸性,C正确;浓硫酸作干燥剂,是因为其有吸水性,D错误。【答案】 C24537968106. (2023·南通期末)探究浓硫酸和铜的反应,下列实验原理、装置和操作均能达到实验目的的是( )A. 用装置甲进行铜和浓硫酸的反应 B. 用装置乙验证SO2C. 用装置丙验证反应生成了CuSO4 D. 用装置丁吸收尾气124537968101【解析】 铜与浓硫酸反应,需要加热,A错误;装置乙中,导管应该长进短出,B错误;反应后的混合溶液中有较浓硫酸,应倒入水中,若溶液变蓝,说明生成CuSO4,C正确;因SO2能与NaOH反应,用碱吸收时要防倒吸,漏斗下沿应贴着液面,D错误。【答案】 C24537968107. (2023·南通期末)下列有关工业制硫酸的说法正确的是( )A. 98%的浓硫酸的物质的量浓度为18.4 mol·L-1B. 反应①中FeS2既是氧化剂又是还原剂C. 该条件下反应②中生成的SO3不能转化为SO2D. 将50 g发烟硫酸与50 g H2O混合,可得到100 g质量分数为50%的硫酸溶液124537968101【答案】 A24537968108. 下列有关铜与过量浓硫酸反应的实验说法,不正确的是( )A. 喷有碱液的棉花是为了防止SO2污染环境B. 试管中析出蓝色固体C. 铜片表面先发黑,反应完全后试管a底部有白色固体124537968101【答案】 B24537968109. 根据下图回答问题:12453796810(1) 上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气?______________________________________________________________________________________________________________________。(2) 写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:__________________________________________________________。1反应前点燃酒精灯,加热烧瓶一会儿,在瓶B、C、D中出现气泡, 熄灭酒精灯,瓶B、C、D中导管液面上升,证明该装置不漏气2453796810(3) 如果用图中的装置检验(2)中反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:A中加入的试剂是______________,作用是________________。B中加入的试剂是____________,作用是______________。C中加入的试剂是__________________________,作用是除尽__________气体。D中加入的试剂是______________,作用是________________。(4) 实验时,C中应观察到的现象是__________________________________________________________。1无水硫酸铜检验 H2O品红溶液检验SO2足量酸性KMnO4溶液SO2澄清石灰水检验 CO2导管有气泡冒出;溶液紫色逐渐变浅;瓶底有少量黑色固体生成245379681010. 以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:12453796810请回答下列问题:(1) 在炉气制造中,黄铁矿粉碎的目的是_______________________________________,生成二氧化硫的化学方程式是___________________________________________。(2) 炉气精制的目的是__________________。(3) 二氧化硫催化氧化的化学方程式是______________________。(4) D中的浓硫酸是不是可以用水代替?______________,原因是________________________________。(5) 尾气的主要成分是____________________________,若将尾气通入氢氧化钙浊液中,最后能得到的副产品是________。1增大反应物的接触的表面积,提高反应速率2Fe2O3+8SO2防止催化剂中毒不可以避免用水吸收三氧化硫形成酸雾二氧化硫、三氧化硫和空气石膏谢谢观看Thank you for watching
学 习 目 标1. 了解硫酸的工业制法。2. 了解硫酸的酸性、浓硫酸的特性。活 动 方 案1. 接触法制硫酸的原料是硫黄、硫铁矿、石膏、有色金属冶炼厂的烟气,在我国主要用黄铁矿。硫酸工业主要设备与流程活动一:了解接触法制硫酸的原理填空:沸腾炉接触室吸收塔SO3+H2O===H2SO42. 尾气的吸收。通常工业上是用氨水来吸收SO2,其反应的化学方程式为_____________________________________________、______________________________________________。SO2+2NH3·H2O===(NH4)2SO3+H2O(NH4)2SO3+SO2+H2O===2NH4HSO33. 工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔;仿照工业上制备硫酸的流程设计出下面的装置,以探究有关问题。请回答下列问题:(1) 写出FeS2与氧气反应的化学方程式:_________________________________________。(2) 从乙装置中出来的气体有________________________。(3) 写出上图丙装置的作用:________________________________。(4) 本实验增加丁装置的目的是_______________________________________________________________________。(5) 本实验设计还存在的较明显缺陷是____________________。8SO2SO2、O2、SO3吸收SO3气体(模拟吸收塔)探究工业上为何采用98.3%的浓硫酸吸收三氧化硫而不用水(吸收产生酸雾)缺少尾气吸收装置化学工业制备的要求:1. 原料廉价且稳定,最好能结合本地地理环境的优势资源,以降低运输成本。2. 从环保、成本等角度选择合适的化学反应,设计合理的反应装置,对原料进行粉碎等预处理,使得原料尽可能地被富集,保证在反应中能充分接触。3. 制备流程简单高效,能耗低,反应放出的热量和剩余物质尽可能加以循环利用,生成的副产物较少。4. 制备过程绿色环保,没有使用或生成对环境有害的物质,若有,须对有害物质进行无害化处理。由于工业战略发展的需要,某地区打算建厂制备硫酸,项目负责人员正在考虑采用硫黄制酸还是硫铁矿制酸。如果你是负责人,你会收集哪些资料作为依据进行选择?【答案】 硫铁矿中FeS2的质量分数一般为20%~50%,制酸工艺过程中所产生的矿渣和废气使生产装置变得较为复杂。而采用硫黄制酸法,工艺流程和设备相对简易。硫黄含杂质少,燃烧生成的气体含杂质少,可免去气体净化的过程,制备过程也不产生矿渣。因此,硫铁矿制酸设备投资几乎是同等规模硫黄制酸设备的两倍。但硫黄原料价格高于硫铁矿,具体选用何种硫酸制工艺,应根据实际条件和要求进行决策。1. 以稀硫酸为例,用电离方程式或离子方程式表示下列酸的通性:(1) 与指示剂作用。 (2) 与活泼金属反应放出氢气。【答案】 Zn+2H+===Zn2++H2↑(3) 与金属氧化物反应生成盐和水。【答案】 CuO+2H+===Cu2++H2O(4) 与碱反应生成盐和水。【答案】 Cu(OH)2+2H+===Cu2++2H2O活动二:认识稀硫酸具有酸的通性(5) 与盐反应生成新盐和新酸。【答案】 MgCO3+2H+===Mg2++H2O+CO2↑2. 工业上常用硫酸跟磷酸钙[Ca3(PO4)2]反应制取磷酸。该方法应用了什么化学原理?【答案】 强酸制弱酸原理。1. 探究浓硫酸的吸水性与脱水性活动三:探究浓硫酸的特性蓝色晶体逐渐变成灰白色浓硫酸有吸水性片刻后纸片发黄变黑并被蚀穿浓硫酸有脱水性试纸变红,但片刻后试纸变黑并被蚀穿浓硫酸有酸性、脱水性开始时烧杯中蔗糖变棕色,然后快速膨胀变成黑色疏松多孔的固体,同时产生大量水蒸气并放出有刺激性气味的气体浓硫酸有脱水性、吸水性和强氧化性(1) 实验Ⅳ过程中反应过程如下图所示。①黑色物质急剧膨胀,长成黑色面包的原因是什么?【答案】 蔗糖炭化后,C与浓硫酸反应产生大量的气体,从而使黑色物质急剧膨胀,长成黑色面包。②蔗糖变黑体现了浓硫酸的什么性质?【答案】 表现了浓硫酸的脱水性和强氧化性。(2) 浓硫酸吸水性和脱水性的有什么区别?由此看出:二者的根本区别在于物质本身是否存在水分子。(3) 浓硫酸常用作气体干燥剂,体现了浓硫酸的什么性质?【答案】 吸水性2. 探究浓硫酸的强氧化性。完成下表中的实验探究,观察现象,并说明该实验体现了浓硫酸的何种性质(酸性、吸水性、脱水性和强氧化性等)。将你所得的结论写出来。在试管底部有灰白色固体出现,加入水中后形成蓝色溶液;放出的气体能使品红褪色浓硫酸有酸性和强氧化性无明显现象浓硫酸有强氧化性,在常温下使铁、铝发生了钝化(1) 实验Ⅴ还可以采用下图装置进行实验①写出该反应的化学方程式。②可拉动的铜丝代替铜片的优点是什么?【答案】 可以拉动铜丝控制反应的进行与停止。③试管c中“浸有NaOH溶液的棉团”的作用是什么?写出反应的化学方程式。【答案】 吸收多余的SO2,以防污染环境,SO2+2NaOH=== Na2SO3+H2O。④将64 g铜片加入盛有浓硫酸(含2 mol H2SO4)的试管中加热,充分反应后,铜片能否完全溶解?请解释原因。【答案】 铜片不能完全溶解,原因是随着反应的进行,硫酸的浓度变小,而铜与稀硫酸不反应。⑤浓硫酸与过量的Zn充分反应,发生的反应有哪些?写出化学方程式。【答案】 Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O,Zn+H2SO4(稀)===ZnSO4+H2↑。 (2) Fe、Al的钝化。常温下,当Fe、Al遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。①“钝化”是化学变化吗?【答案】 是化学变化,金属表面生成致密的氧化物,有新物质生成。②常温下应如何储运浓硫酸?【答案】 常温下,浓硫酸能使Fe、Al“钝化”,故可用铝槽(或铁罐)车储运浓硫酸。(3) 与非金属反应加热时,浓硫酸可以和C、S、P等非金属反应,写出浓硫酸与木炭反应的化学方程式。1. 鉴别稀硫酸与浓硫酸。在两个容器中盛有相同体积的浓硫酸和稀硫酸,设计简单的方法将其中的浓硫酸挑出来。看看谁设计的方法多?谁设计的方法简单?谁设计的方法最有创意?【答案】 (1) 密度法:用密度计测量两者的密度,密度大的为浓硫酸。(2) 稀释法:分别取少量两种浓度的硫酸加入一定量水中,放出热量大的为浓硫酸。活动四:浓硫酸、稀硫酸的鉴别,利用废铜屑制备硫酸铜溶液(3) 吸水法:用试管分别取少量,再加入少量胆矾,能使胆矾变灰白的为浓硫酸。(4) 脱水法:用玻璃棒分别蘸取少量液体涂在纸片上,能使纸片变黑的为浓硫酸。(5) 强氧化性:用试管分别取少量两种浓度的硫酸,再加入少量铜片,加热后能和铜片反应的为浓硫酸。(6) 利用黏稠性:轻轻振荡两份溶液,观察液体的黏稠性,黏稠性大的为浓硫酸。2. 利用废铜屑制备硫酸铜溶液。某课外兴趣小组利用废铜屑制备硫酸铜溶液,设计了下列几种实验方案:方案一:以废铜屑和浓硫酸反应制取硫酸铜溶液。方案二:将废铜屑在空气中灼烧后,再投入稀硫酸中可制得硫酸铜溶液。方案三:将废铜屑加入稀硫酸与双氧水的混合液中,并用30~40 ℃水浴加热,一段时间后,铜完全溶解,得到硫酸铜溶液。其实验流程如下:(1) 方案二与方案一相比,具有哪些优点?【答案】 制取等量的硫酸铜更加节省硫酸,且没有SO2等有害气体产生。(2) ①写出方案三的溶解过程中发生反应的离子方程式。②猜想该实验采用30~40 ℃水浴加热的原因是什么?【答案】 H2O2受热易分解。活动五:认识常见的硫酸盐课 堂 反 馈245137968101. 浓硫酸与下列物质作用时,只表现强氧化性的是( )A. 红热木炭 B. 木材炭化 C. 蓝色硫酸铜晶体 D. 氧化铜【答案】 A245137968102. 工业上采用接触法制硫酸,其中在接触室进行的反应是( )24513796810【解析】 工业接触法制硫酸时,硫铁矿或硫黄在沸腾炉灼烧来制取二氧化硫气体,A、B错误;二氧化硫和氧气在接触室中发生催化氧化来制备三氧化硫,C正确;三氧化硫在吸收塔中被98.3%的浓硫酸吸收制取发烟硫酸,D错误。【答案】 C24537968103. 浓硫酸有许多重要的性质,与含有水分的蔗糖作用过程中不能显示的性质是( )A. 吸水性 B. 脱水性C. 强氧化性 D. 酸性【答案】 D124537968104. 在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环。下列说法不正确的是( )A. 从①处通入SO3,整个吸收操作采取逆流的形式B. 从②处喷下98.3%的浓硫酸,瓷环的作用是增大接触面积C. 从③处导出的气体只含有少量SO2,可直接排入大气D. 从④处流出的是可用水或稀硫酸稀释的浓硫酸124537968101【解析】 三氧化硫的吸收通常使用98.3%的浓硫酸,不用水或稀硫酸,原因是水或稀硫酸吸收三氧化硫时容易形成酸雾,吸收效率低,不利于三氧化硫的吸收;气体的吸收常采用逆流原理,这样有利于气、液的充分接触,吸收效果好;从吸收塔上部导出的气体是没有起反应的O2和少量二氧化硫,直接排入大气会污染环境,所以应用吸收剂吸收或循环使用。【答案】 C阅读下列材料,完成5~7题。硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料和盐类。我国工业上一般以黄铁矿为原料来制备硫酸。工业制硫酸涉及下列反应:24537968105. (2023·南通期末)下列有关硫及其化合物的性质与用途具有对应关系的是( )A. 硫具有还原性,可用硫黄处理洒落的汞单质B. 二氧化硫具有氧化性,可用作葡萄酒的抗氧化剂C. 稀硫酸具有酸性,可用于去除铁锈D. 浓硫酸具有脱水性,可用于干燥二氧化硫124537968101【解析】 Hg+S===HgS,硫的化合价降低,体现氧化性,A错误;SO2具有还原性,作抗氧化剂,B错误;稀硫酸除铁锈的离子反应为Fe2O3+6H+===2Fe3++3H2O,体现酸性,C正确;浓硫酸作干燥剂,是因为其有吸水性,D错误。【答案】 C24537968106. (2023·南通期末)探究浓硫酸和铜的反应,下列实验原理、装置和操作均能达到实验目的的是( )A. 用装置甲进行铜和浓硫酸的反应 B. 用装置乙验证SO2C. 用装置丙验证反应生成了CuSO4 D. 用装置丁吸收尾气124537968101【解析】 铜与浓硫酸反应,需要加热,A错误;装置乙中,导管应该长进短出,B错误;反应后的混合溶液中有较浓硫酸,应倒入水中,若溶液变蓝,说明生成CuSO4,C正确;因SO2能与NaOH反应,用碱吸收时要防倒吸,漏斗下沿应贴着液面,D错误。【答案】 C24537968107. (2023·南通期末)下列有关工业制硫酸的说法正确的是( )A. 98%的浓硫酸的物质的量浓度为18.4 mol·L-1B. 反应①中FeS2既是氧化剂又是还原剂C. 该条件下反应②中生成的SO3不能转化为SO2D. 将50 g发烟硫酸与50 g H2O混合,可得到100 g质量分数为50%的硫酸溶液124537968101【答案】 A24537968108. 下列有关铜与过量浓硫酸反应的实验说法,不正确的是( )A. 喷有碱液的棉花是为了防止SO2污染环境B. 试管中析出蓝色固体C. 铜片表面先发黑,反应完全后试管a底部有白色固体124537968101【答案】 B24537968109. 根据下图回答问题:12453796810(1) 上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气?______________________________________________________________________________________________________________________。(2) 写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:__________________________________________________________。1反应前点燃酒精灯,加热烧瓶一会儿,在瓶B、C、D中出现气泡, 熄灭酒精灯,瓶B、C、D中导管液面上升,证明该装置不漏气2453796810(3) 如果用图中的装置检验(2)中反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:A中加入的试剂是______________,作用是________________。B中加入的试剂是____________,作用是______________。C中加入的试剂是__________________________,作用是除尽__________气体。D中加入的试剂是______________,作用是________________。(4) 实验时,C中应观察到的现象是__________________________________________________________。1无水硫酸铜检验 H2O品红溶液检验SO2足量酸性KMnO4溶液SO2澄清石灰水检验 CO2导管有气泡冒出;溶液紫色逐渐变浅;瓶底有少量黑色固体生成245379681010. 以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:12453796810请回答下列问题:(1) 在炉气制造中,黄铁矿粉碎的目的是_______________________________________,生成二氧化硫的化学方程式是___________________________________________。(2) 炉气精制的目的是__________________。(3) 二氧化硫催化氧化的化学方程式是______________________。(4) D中的浓硫酸是不是可以用水代替?______________,原因是________________________________。(5) 尾气的主要成分是____________________________,若将尾气通入氢氧化钙浊液中,最后能得到的副产品是________。1增大反应物的接触的表面积,提高反应速率2Fe2O3+8SO2防止催化剂中毒不可以避免用水吸收三氧化硫形成酸雾二氧化硫、三氧化硫和空气石膏谢谢观看Thank you for watching
相关资料
更多









