
2021_2022学年高中化学专题4硫及环境保护阶段素养提升课学案苏教版必修1
展开阶段素养提升课 专题4
以“二氧化硫的性质”为例复习硫与环境保护
主题目标 | 1.以真实的情景“二氧化硫作为食品添加剂及二氧化硫对环境的危害”为例复习硫及其化合物与环境保护问题。 2.以硫酸工业生产情景,从不同层次认识硫单质以及硫的化合物的多样性及它们之间的相互转化关系。 3.以解决现实中环境污染问题,培育学生的核心素养。 |
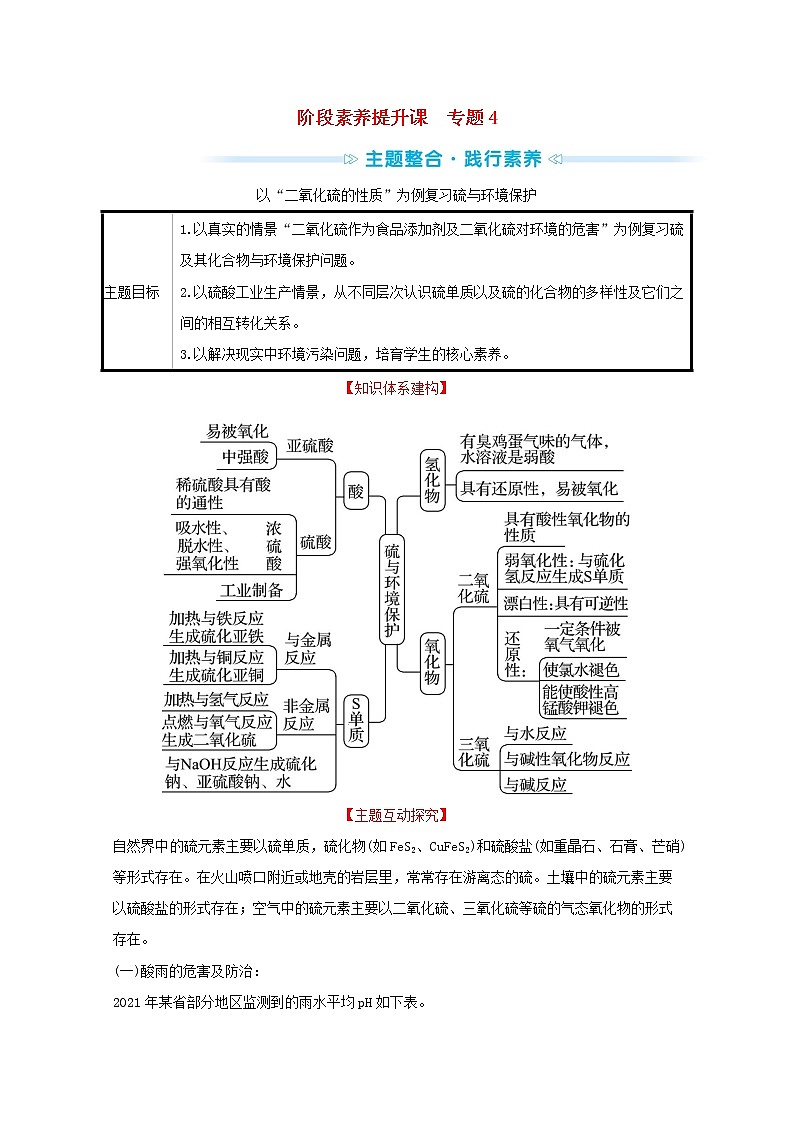
【知识体系建构】
【主题互动探究】
自然界中的硫元素主要以硫单质,硫化物(如FeS2、CuFeS2)和硫酸盐(如重晶石、石膏、芒硝)等形式存在。在火山喷口附近或地壳的岩层里,常常存在游离态的硫。土壤中的硫元素主要以硫酸盐的形式存在;空气中的硫元素主要以二氧化硫、三氧化硫等硫的气态氧化物的形式存在。
(一)酸雨的危害及防治:
2021年某省部分地区监测到的雨水平均pH如下表。
城市 | A | B | C | D | E | F | G |
雨水平均pH | 4.47 | 4.8 | 4.54 | 6.37 | 4.86 | 4.83 | 4.58 |
请回答下列问题:
(1)表中列举的7个地区中,没有酸雨污染的地区是_______ ;
(2)若酸雨的主要成分为H2SO4和HNO3,请写出下列化学方程式:
含H2SO4的酸雨腐蚀某地的石灰石_________;
含HNO3的酸雨与撒在田地里的熟石灰反应_____。
【解析】(1)城市D的雨水的pH是6.37,大于5.6,没有受到酸雨污染;
(2)含H2SO4的酸雨腐蚀某地的石灰石的化学方程式为:H2SO4+CaCO3===CaSO4+CO2↑+H2O;
含HNO3的酸雨与撒在田地里的熟石灰反应的化学方程式为:2HNO3+Ca(OH)2===Ca(NO3)2+2H2O。
答案:(1)D
(2)H2SO4+CaCO3===CaSO4+CO2↑+H2O
2HNO3+Ca(OH)2===Ca(NO3)2+2H2O
(二)硫及其化合物的转化:
硫酸盐矿物是金属元素阳离子(包括铵根)和硫酸根相化合而成的盐类,由于硫是一种变价元素,在自然界它可以呈不同的价态形成不同的矿物。回答下列问题:
(1)实验室用如图所示装置制取连二亚硫酸钠(Na2S2O4)。
①实验中C装置的作用是____________ 。
②B装置中用甲醇作溶剂,反应过程中有CO2生成,写出该反应的化学方程式 ____。
(2)科学酿酒加SO2等辅料。我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25 g·L-1。
①葡萄酒中添加SO2的作用可能是_____________。
A.氧化细菌 B.抗氧化
C.漂白 D.增酸作用
②利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下图的实验:
得出实验结论:干白葡萄酒中不含SO2或H2SO3。这个结论是否合理?说明理由。 __。
【解析】(1)①吸收SO2,防止污染空气。
②B装置中,SO2与HCOONa、NaOH的甲醇溶液反应制取Na2S2O4,同时生成CO2,配平化学方程式为HCOONa+2SO2+NaOH===Na2S2O4+CO2+H2O。
(2)①葡萄酒中添加SO2的作用是抗氧化、增酸作用。
②根据图中对比实验,浓度低的亚硫酸溶液不能使品红溶液褪色,干白葡萄酒中的SO2或H2SO3含量很低,品红溶液滴入干白葡萄酒,红色不褪去,不能说明干白葡萄酒不含SO2或H2SO3。
答案:(1)①吸收SO2,防止污染空气
②HCOONa+2SO2+NaOH===Na2S2O4+CO2+H2O
(2)①BD
②不合理,实验对比说明浓度低的亚硫酸溶液不能使品红溶液褪色,而干白葡萄酒中的SO2或H2SO3含量很低,故不能使品红褪色
1.含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3很容易转化为硫酸,写出其反应的化学方程式,并标明电子转移的方向和数目
___________。
(2)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面_______,则发生了钝化;若铁棒表面_____,则未发生反应。
(3)用Na2SO3吸收法是治理SO2污染的一种方法,其原理为(用化学方程式表示):___________。
(4)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式 ______________。
【解析】(1)H2SO3与空气中的O2发生反应生成H2SO4;
(2)铁棒经浓硫酸处理,若钝化则生成铁的氧化物,铁的氧化物不与CuSO4溶液反应,若没有钝化,则铁棒与CuSO4溶液发生反应:Fe+CuSO4===Cu+FeSO4;
(3)Na2SO3溶液与SO2气体反应生成NaHSO3;
(4)CO和SO2发生氧化还原反应:
SO2+2COS+2CO2。
答案:(1)
(2)无明显现象(无现象也可以)
有红色物质析出
(3)Na2SO3+SO2+H2O===2NaHSO3
(4)SO2+2COS+2CO2
2.食品、大气、工业尾气中的SO2均需严格检测或转化吸收。
(1)下列有关SO2的检测或吸收方法:
A.氧化还原反应法:用饱和碘水测定葡萄酒中SO2的浓度
B.沉淀法:用Ba(OH)2溶液沉淀SO2,然后将沉淀在空气中洗涤、过滤、干燥、称重BaSO3,以测定大气中SO2的浓度
C.氨酸法:用氨水吸收尾气中的SO2后再将吸收液与硫酸反应,将富集后的SO2循环使用
D.石灰-石膏法:常温下用石灰石吸收尾气中的SO2得到CaSO3,再经氧化,所得物质可用于生产石膏
上述方法正确的是_______。
(2)为了验证SO2的性质,某同学利用输液管设计了如下微型实验:
①仪器A的名称是__________。
②装置C中NaOH的作用是 _____。
③下列说法正确的是__________。
A.装置1、3、4中溶液均褪色,可证明SO2具有漂白性
B.装置2中石蕊试液只变红不褪色,证明SO2是一种酸性氧化物
C.反应结束后,可由a导管向装置中加水,将气体赶出后再拆装置
D.在a导管处用向下排空气法收集SO2
【解析】(1)AC。饱和碘水能与葡萄酒中的SO2发生反应,A正确;BaSO3能被空气中的氧气氧化成BaSO4,B错误;氨水吸收SO2生成(NH4)2SO3或NH4HSO3,(NH4)2SO3或NH4HSO3与H2SO4反应生成SO2,富集后的SO2可循环使用,C正确;常温下石灰石与SO2不反应,D错误。
(2)①仪器A为分液漏斗。
②SO2有毒,污染空气,SO2属于酸性气体,因此氢氧化钠的作用是尾气处理,即吸收多余的SO2。
③品红溶液褪色,说明SO2具有漂白性,溴水、高锰酸钾溶液褪色,证明SO2具有还原性,A错误;SO2是酸性氧化物,使石蕊试液只变红,不褪色,B正确;SO2易溶于水,由a导管向装置中加水,将气体赶出后再拆装置,C正确;SO2的密度大于空气,用向上排空气法收集,D错误。
答案:(1)AC (2)①分液漏斗
②吸收多余的SO2,防止污染空气 ③BC









