
人教版 (2019)必修 第二册第一节 硫及其化合物一课一练
展开5.1硫及其化合物同步练习-人教版高中化学必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
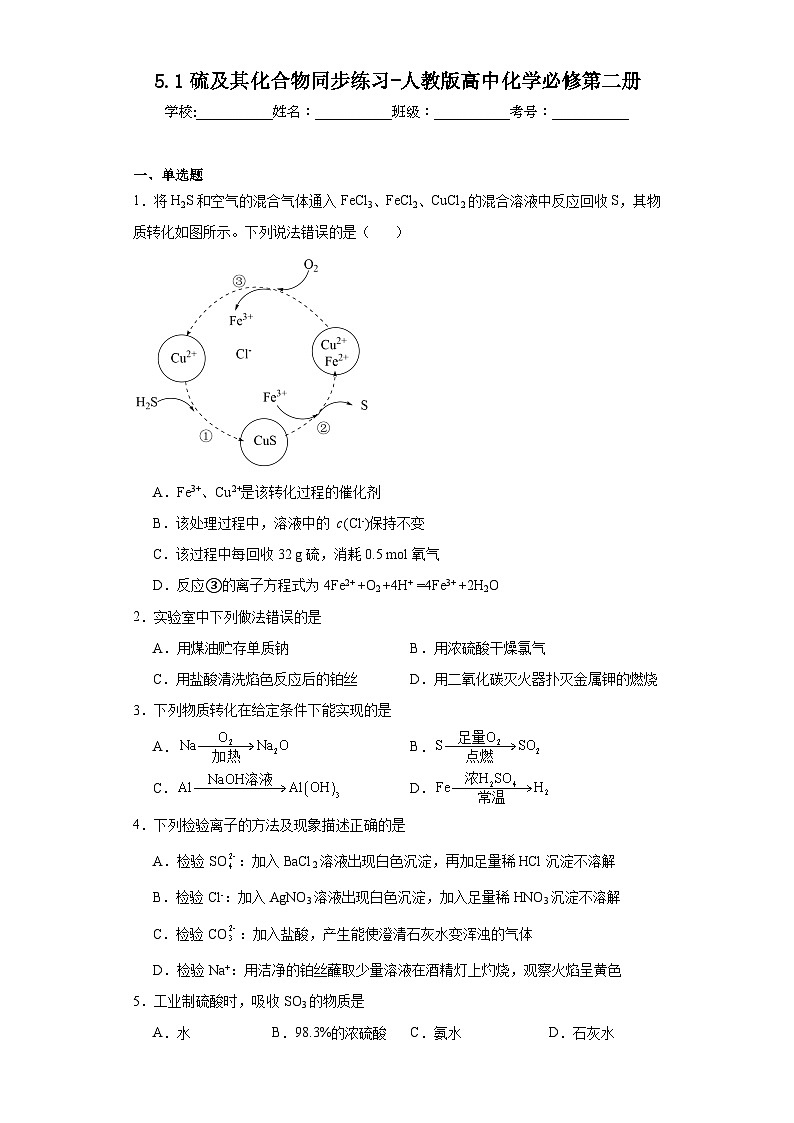
1.将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( )
A.Fe3+、Cu2+是该转化过程的催化剂
B.该处理过程中,溶液中的 c(Cl-)保持不变
C.该过程中每回收32 g硫,消耗0.5 mol氧气
D.反应③的离子方程式为4Fe2+ +O2 +4H+ =4Fe3+ +2H2O
2.实验室中下列做法错误的是
A.用煤油贮存单质钠 B.用浓硫酸干燥氯气
C.用盐酸清洗焰色反应后的铂丝 D.用二氧化碳灭火器扑灭金属钾的燃烧
3.下列物质转化在给定条件下能实现的是
A. B.
C. D.
4.下列检验离子的方法及现象描述正确的是
A.检验SO:加入BaCl2溶液出现白色沉淀,再加足量稀HCl沉淀不溶解
B.检验Cl-:加入AgNO3溶液出现白色沉淀,加入足量稀HNO3沉淀不溶解
C.检验CO:加入盐酸,产生能使澄清石灰水变浑浊的气体
D.检验Na+:用洁净的铂丝蘸取少量溶液在酒精灯上灼烧,观察火焰呈黄色
5.工业制硫酸时,吸收SO3的物质是
A.水 B.98.3%的浓硫酸 C.氨水 D.石灰水
6.下列说法正确的是
A.氯元素在自然界中既以化合态存在,也以游离态存在
B.二氧化硫使含有酚酞的NaOH溶液褪色,是因为SO2具有漂白性
C.氧化镁的熔点高达2800℃,可用于制造耐火坩埚
D.雨水样品在空气中放置2小时后,测得pH变小,主要是因为吸收了空气中的CO2
7.下列叙述中正确的是
A.向某溶液中加入CCl4, CCl4层显紫红色,证明原溶液中存在I-
B.向某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
C.向某无色溶液中加入Ba(NO3)2溶液,产生白色沉淀,则原溶液中一定含有SO42-
D.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
8.下列各组物质混合后,没有明显现象的是
①H2S和SO2 ②SO2和SO3
③SO2和氯水 ④SO3(气)和Cl2
⑤H2S和SO3(气) ⑥H2S和Cl2
A.①③⑥ B.②④
C.②⑤⑥ D.③④⑤
9.下列实验中,对应的现象以及结论都正确的是
选项 | 实验 | 现象 | 结论 |
A | 将浓硫酸滴入蔗糖中产生的气体通入品红溶液中 | 品红褪色 | 浓硫酸具有强氧化性 |
B | 将(NH4)2SO3加热产生的气体通入BaCl2溶液中 | 无明显现象 | SO2与BaCl2溶液作用不产生BaSO4沉淀 |
C | 将Fe2O3溶于足量HI溶液后,加入2滴淀粉溶液 | 溶液颜色不变 | 反应生成Fel3和H₂O |
D | 往漂白粉中加入浓硫酸 | 产生黄绿色气体 | Cl2的氧化性比H₂SO4的强 |
A.A B.B C.C D.D
10.对于下列实验。描述其反应的离子方程式正确的是
A.向氢氧化钠溶液中通入过量气体:
B.向溴水中通入适量气体:
C.溶液与过量的NaOH溶液反应:
D.向澄清石灰水中通入少量气体:
二、填空题
11.含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-2价、0价、+4价、+6价四种,其不同价态的物质间可相互转化,完成下列填空:
(1)写出硫与铁反应的化学方程式 。
(2)将硫化氢气体与二氧化硫气体在集气瓶中混合发生反应,其中硫化氢呈现 (选填“氧化性”、“还原性”)
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是 。
(4)将二氧化硫通入含酚酞的NaOH溶液,红色褪去,体现二氧化硫 (性质)。
(5)硫酸盐的种类很多且应用广泛,医疗上采用 作X射线透视肠胃的内服药剂。
12.分类法在化学学习中应用广泛。
(1)为了保护环境,应减少SO2在大气中的排放。SO2属于酸性氧化物,可与NaOH、 (填与NaOH不同类别的一种具体物质)等反应。写出SO2与NaOH反应的化学方程式 。
(2)氯化铁(FeCl3)可用于金属蚀刻、污水处理等,是重要的化工原料。写出两个生成FeCl3的化学方程式(以含铁元素的不同类别物质为原料)。
① 。
② 。
判断正误
13.浓硫酸具有强氧化性,所以浓硫酸不可用于干燥H2和CO。(_______)
14.铜片溶于热的浓硫酸,体现了浓硫酸的酸性和强氧化性。(_______)
15.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO。(_______)
16.将少量铜加入浓硫酸中加热,很快能观察到溶液变为蓝色。(_______)
17.50 mL 18.4 mol·L-1的浓硫酸与足量的铜反应,可产生SO2物质的量为0.46 mol。(_______)
18.一定量浓硫酸中加入足量锌粒加热,产生的气体为SO2和H2的混合气体。(_______)
19.将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化。(_______)
20.“飘尘”是物质燃烧时产生的粒子漂浮物,颗粒很小(直径小于10-7m),不易沉降(可漂浮数小时甚至数年),它与空气中SO2、O2接触时,SO2部分转化为SO3,使空气中酸度增加形成酸雨。
(1)下列关于SO2的叙述中,正确的是 ;
A.SO2既可以做氧化剂,也可以做还原剂 B.SO2不是大汽污染物 C.大气中SO2的主要来源是汽车排出的尾气 D.SO2具有漂白性,因而可以使石蕊溶液褪色
(2)下列反应中,SO2表现了还原性的是 ;
A.SO2+H2O⇌H2SO3 B.SO2+2NaOH=Na2CO3+H2O C.2SO2+O2 2SO3 D.SO2+CaO=CaSO3
(3)不能鉴别二氧化碳和二氧化硫的试剂是 ;
A.品红溶液 B.澄清石灰水 C.溴水 D.酸性高锰酸钾溶液
(4)下列哪种危害不是酸雨导致的 ;
A.造成洪涝灾害 B.腐蚀建筑物 C.恶化人类环境 D.导致树木枯萎
(5)根据SO2通入不同溶液中实验现象,所得结论不正确的是 ;
| 溶液 | 现象 | 结论 |
A | 含HCl、BaCl2的FeCl3溶液 | 产生白色沉淀 | SO2有还原性 |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 |
D | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
(6)减少酸雨产生的途径可采取下列的哪些措施 。
①少用煤做燃料 ②把工厂烟囱造高 ③燃料脱硫 ④飞机、汽车等交通工具采用清洁燃料,如天然气等 ⑤开发新能源
21.按要求回答下列问题。
(1)镁橄榄石(Mg2SiO4)用氧化物的形式表示为 。
(2)接触法制硫酸工艺中,在设备 中实现硫铁矿的煅烧制得SO2气体。
(3)写出醋酸在水中的电离方程式 。
(4)写出少量氯气通入碘化钾溶液的化学方程式 。
(5)在制作印刷电路板的过程中常利用铜和氯化铁溶液反应,写出离子方程式: 。
22.某同学向50 mL浓硫酸溶液(足量)中加入3.2gCu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是 ,生成SO2的体积为(标准状况下) mL。
(2)将题干中反应后的溶液稀释到500 mL,取出50 mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81 g,求原浓硫酸的物质的量浓度 (写出计算过程)。
23.硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料和盐类等。工业上一般以硫磺或黄铁矿为原料来制备硫酸。
请根据以上转化关系填写下列空白:
(1)以硫磺为原料制备二氧化硫的化学方程式 ;
(2)吸收剂b为 ;
(3)流程中SO3经吸收剂b吸收后,溶液中除H2SO4外还存在一种含硫的化合物(硫的化合价为+6),经测定其式量为178,请推测其可能的化学式 ;
(4)设计实验方案检验二氧化硫气体的存在 。
24.某实验小组在探究SO2性质的时候,发现若将SO2气体通入足量的Ba(OH)2溶液中,有白色沉淀生成,再滴入稀硝酸,沉淀无明显变化,但有无色气体生成,遇空气无色气体变为红棕色。
回答下列问题:
(1)写出上述实验中通入SO2生成白色沉淀的离子方程式: 。请用离子方程式表示加入稀硝酸后生成无色气体的原因: 。
(2)若将SO2气体通入足量的BaCl2溶液中,则无明显现象产生。
①同时向BaCl2溶液中通入NH3和SO2有白色沉淀产生,产生沉淀的化学式 。
②同时向BaCl2溶液中通入SO2和Cl2有白色沉淀产生,产生沉淀的化学式 。
③同时向BaCl2溶液中通入SO2和NO2是否有白色沉淀生成,请判断并说明原因 。
(3)若将SO2通入H2S溶液中,有淡黄色沉淀生成,请写出反应的化学方程式: ,该反应中体现了SO2的 (填"还原性"或"氧化性")。
25.硫的化学性质
(1)从化合价角度分析,硫单质可能具有的性质: 。
(2)氧化性:分别写出S与金属Fe、Cu的反应以及H2的反应的化学方程式 。
(3)还原性:硫在空气中燃烧,产生 火焰;在纯氧中燃烧,产生 火焰,燃烧产物为SO2,化学方程式为 。
26.若用下图装置制备干燥纯净的CO。
(1)装置中a和b的作用分别是 、
(2)虚线框内为CO收集装置,可以是
三、实验题
27.为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略)。
实验过程:
Ⅰ.查好装置的气密性后,在各仪器中添加相应试剂
Ⅱ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4
Ⅲ.打开活塞a,滴加一定量的浓盐酸,给A加热
Ⅳ.当B中溶液变黄时,停止加热,关闭K2
Ⅴ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅵ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3
Ⅶ.更换试管D,重复过程V,检验B溶液中的离子
(1)检验虚线框内装置气密性的操作是 。
(2)B棉花中浸润的溶液为 。实验Ⅱ通入N2的作用是 。
(3)C中发生反应的化学方程式 。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(5)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为 。
(6)甲、乙、丙三位同学分别完成了上述实验,结论如表所示。他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是 (填“甲”“乙”“丙”)。
| 过程V,B溶液中含有的离子 | 过程VII,B溶液中含有的离子 |
甲 | 既有Fe3+又有Fe2+ | 有 |
乙 | 有Fe3+无Fe2+ | 有 |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
28.二氧化硫具有漂白性,工业上常用二氧化硫来漂白纸浆、毛、丝、草帽等。此外二氧化硫还具有还原性,可用作防腐剂,甲组同学拟利用Mg粉与浓硫酸反应制取22.4L (标准状况下)SO2。实验方案设计如下:取24g镁粉与100Ml98%的浓硫酸(含2.204molH2SO4)混合,加热充分反应,待Mg粉全部溶解后,干燥并收集气体。
(1)写出Mg粉与浓硫酸反应制备SO2的化学方程式: ;
(2)乙组同学认为:按甲组同学实验方案无法达到实验目的,并且制得气体应该含有杂质,该杂质为 (填化学式);
(3)为了检验甲组同学所制气体的成分,乙组同学按甲组同学的实验方案制备气体,并设计了如图所示的实验装置进行检验(已知酸性高锰酸钾溶液及B中试剂均过量),其中C是CuO固体,D是无水CuSO4。
①A中试剂是品红溶液,作用是 ;
②B中所装试剂为 ;
③证明气体中混有杂质气体的实验现象是: ;
(4)将二氧化硫气体通入FeCl3溶液中反应一段时间后,取少量生成的溶液,分成两份,一份滴加KSCN溶液,溶液未变红色,另一份滴加稀盐酸酸化的BaCl2溶液,生成了白色沉淀,请写出二氧化硫气体通入FeCl3溶液时发生的离子反应方程式 。
29.某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质(夹持装置已略去)。
(1)试管①中反应的化学方程式是 ;其中体现浓硫酸的 性和 性。
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是 ;证明生成的气体具有 性。若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,则说明生成的气体具有 性。
(3)试管③中的试剂为NaOH溶液,其作用是 ,反应的离子方程式是 。
参考答案:
1.B
2.D
3.B
4.D
5.B
6.C
7.D
8.B
9.A
10.A
11. S+FeFeS 还原性 硫酸 酸性氧化物 硫酸钡
12.(1) H2O或Na2O SO2+2NaOH=Na2SO3+H2O
(2) 2Fe+3Cl22FeCl3(或Fe(OH)3+3HCl=FeCl3+3H2O) Fe2O3+6HCl=2FeCl3+3H2O(或3BaCl2+Fe2(SO4)3=2FeCl3+3BaSO4↓)
13.错误 14.正确 15.错误 16.错误 17.错误 18.正确 19.错误
20. A C B A C ①③④⑤
21. 2MgO•SiO2 沸腾炉 CH3COOH⇌CH3COO﹣+H+ Cl2+2I﹣=I2+2Cl﹣ Cu+2Fe3+═Cu2++2Fe2+
22. 0.1 mol 1120 18
23.(1)S+O2SO2
(2)98.3%的浓硫酸
(3)H2S2O7或H2SO4·SO3或2SO3·H2O
(4)将气体通入品红溶液,若观察到溶液颜色褪色,加热后溶液又恢复红色则可以证明有二氧化硫气体
24.(1) Ba2++2OH-+SO2=BaSO3↓+H2O 3BaSO3+2H++2NO=3BaSO4+2NO↑+H2O
(2) BaSO3 BaSO4 有白色沉淀生成;二氧化氮溶于水为稀硝酸具有强氧化性,氧化二氧化硫为硫酸,硫酸和氯化钡生成硫酸钡白色沉淀
(3) 2H2S+SO2=3S↓+2H2O 氧化性
25.(1)既表现氧化性,也表现还原性
(2)Fe+SFeS、Cu+SCu2S、H2+S H2S
(3) 淡蓝色 蓝紫色 S+O2SO2
26.(1) 平衡压强,便于分液漏斗中的液体顺利加入反应器中 起安全瓶作用,防止c中的液体倒吸进入反应器中
(2)真空袋(或球胆等)
27. 关闭K1、K2,打开分液漏斗的盖子和活塞,向其中加水,一段时间后分液漏斗尖嘴处不再滴液即证明气密性良好 NaOH溶液 排除装置内的空气,防止FeCl2溶液被O2氧化 Na2SO3+H2SO4=Na2SO4+SO2↑+H2O 70%的硫酸中的H+的浓度比98%的硫酸中的H+的浓度大 2MnO+5SO2+2H2O=2Mn2++5SO+4H+ 甲、丙
28.(1)Mg+2H2SO4(浓)MgSO4+SO2↑+2H2O
(2)H2
(3) 检验SO2 浓硫酸 C中黑色粉末变成红色D中白色粉末变成蓝色
(4)2Fe3++SO2+2H2O=2Fe2+++4H+
29. Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O 酸 氧化(或强氧化) 品红溶液褪色 漂白 还原 吸收尾气,防止污染环境 SO2+2OH-=+H2O
人教版 (2019)必修 第二册第一节 硫及其化合物练习: 这是一份人教版 (2019)必修 第二册<a href="/hx/tb_c4000033_t7/?tag_id=28" target="_blank">第一节 硫及其化合物练习</a>,共14页。试卷主要包含了选择题,填空题,解答题等内容,欢迎下载使用。
高中人教版 (2019)第一节 硫及其化合物同步训练题: 这是一份高中人教版 (2019)<a href="/hx/tb_c4000033_t7/?tag_id=28" target="_blank">第一节 硫及其化合物同步训练题</a>,共25页。试卷主要包含了单选题,填空题,判断题,解答题等内容,欢迎下载使用。
人教版 (2019)必修 第二册第一节 硫及其化合物随堂练习题: 这是一份人教版 (2019)必修 第二册<a href="/hx/tb_c4000033_t7/?tag_id=28" target="_blank">第一节 硫及其化合物随堂练习题</a>,共21页。试卷主要包含了单选题,填空题,判断题,解答题等内容,欢迎下载使用。













