



苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡优秀课件ppt
展开学会运用电离平衡常数描述弱酸弱碱和水的电离程度
1.了解电离平衡常数的含义2.认识强酸制弱酸的本质
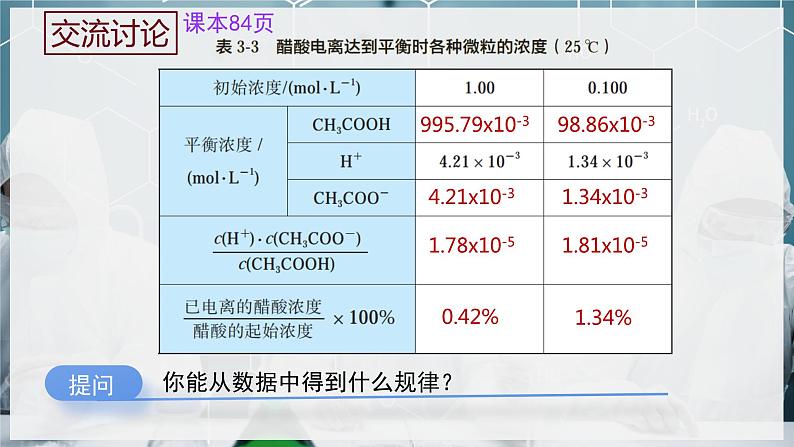
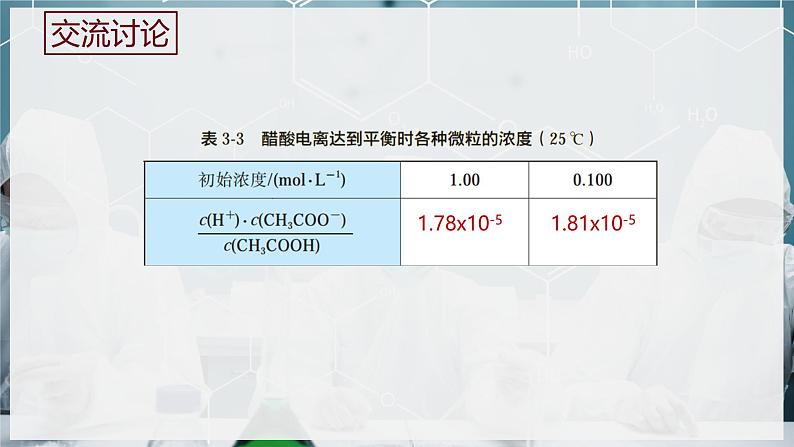
995.79x10-3
在一定条件下,当弱电解质在水溶液中达到电离平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离的分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,用K表示。
弱酸的电离常数用Ka表示,弱碱的电离常数Kb表示。
1.电离平衡常数的概念
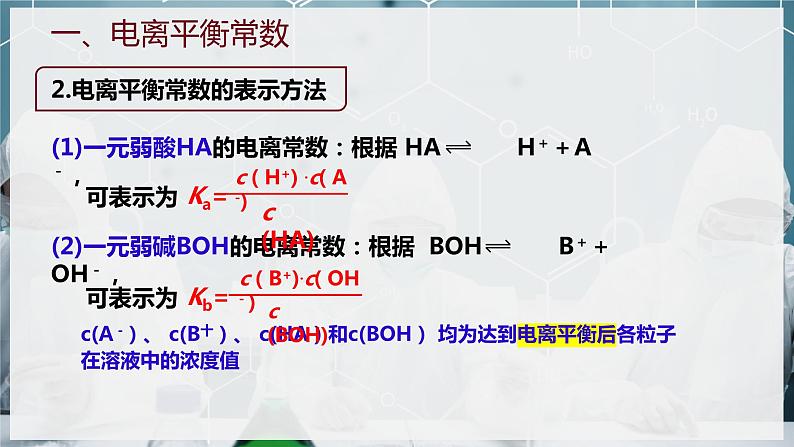
2.电离平衡常数的表示方法
c(A -)、 c(B十)、 c(HA)和c(BOH) 均为达到电离平衡后各粒子在溶液中的浓度值
(1)一元弱酸HA的电离常数:根据 HA H++A-,
(2)一元弱碱BOH的电离常数:根据 BOH B++OH-,
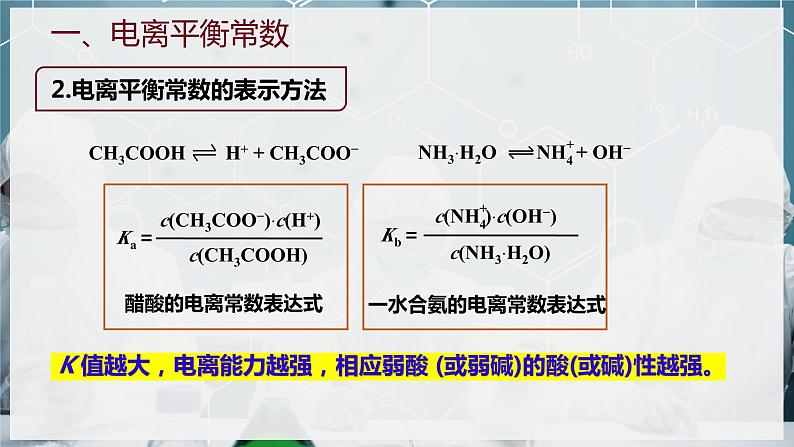
NH3·H2O NH + OH−
CH3COOH H+ + CH3COO−
K 值越大,电离能力越强,相应弱酸 (或弱碱)的酸(或碱)性越强。
一水合氨的电离常数表达式
(3)多元弱酸、多元弱碱的电离平衡常数 多元弱酸的电离是分步进行的,每步各有电离平衡常数,通常用K1、K2等来分别表示。例如, H2CO3 H++HCO3- HCO3- H++CO32-
电离常数的大小:Ka1≫Ka2;多元弱酸的酸性主要由第一步电离决定。
3.电离平衡常数的影响因素
电解质越弱,Ka(或Kb)越小,越难电离,酸 (碱)的酸(碱)性越弱。
1.电离度的概念及表示方法
电离度:表示弱电解质在水中电离程度的物理量。常用α表示。
电离度实质上是一种平衡转化率,表示弱电解质在水中的电离程度。
当温度和浓度相同时,一元弱酸的α越大,Ka越大、酸性越强。
弱电解质本身的性质。(决定性因素)
乙酰水杨酸(HA)是一种弱酸。在一定温度下,0.1ml/L的乙酰水杨酸溶液中,乙酰水杨酸的电离度为5.7%,求该酸的电离平衡常数。
HA ⇌ H+ + A-
HAc ⇌ H+ + Ac-
始: c 0 0 变: 平:
x x x
c-x x x
一元强酸与一元弱酸的比较
1.同体积、同物质的量浓度的一元强酸与一元弱酸的比较
2.同体积、同c(H+)的一元强酸与一元弱酸的比较
3.25 ℃时,部分物质的电离平衡常数如下表所示:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为 。 (2)试写出向NaClO和CH3COONa的混合溶液中通入少量CO2的化学方程式: 。
三、强酸制弱酸的反应规律
离子反应总是向着离子浓度减小的方向进行。
这里的“较强酸“与”较弱酸”是一组相对概念,常常依据酸的电离平衡常数的大小来判断。
对于HCl、H2SO4等实际的强酸,可将它的电离平衡常数视为无穷大。
例: HCl + NaF = NaCl + HF
1.一元酸的较强酸制较弱酸的反应规律
若三种一元酸HA、HB、HC的电离平衡常数Ka(HA)>Ka(HB)>Ka(HC),则酸性由强到弱是: ,则酸根离子结合H+的能力: ,则可发生的反应有:
(2)试写出向NaClO和CH3COONa的混合溶液中通入少量CO2的化学方程式: 。
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡教学课件ppt,共13页。
苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡获奖课件ppt: 这是一份苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡获奖课件ppt,共17页。PPT课件主要包含了H2O,水是良好的溶剂,水的电离,水的电离平衡,水的离子积,水的电离常数,水的离子积常数,1Ⅹ10-14,影响因素,只与温度有关等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡优质ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡优质ppt课件,共31页。PPT课件主要包含了复习回顾,常见的强电解质,1强酸,2强碱,“=”,常见的弱电解质,1弱酸,“⇌”,习题研究,dfh等内容,欢迎下载使用。













