



苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡获奖课件ppt
展开纯水无色无味,显中性(任何温度下)
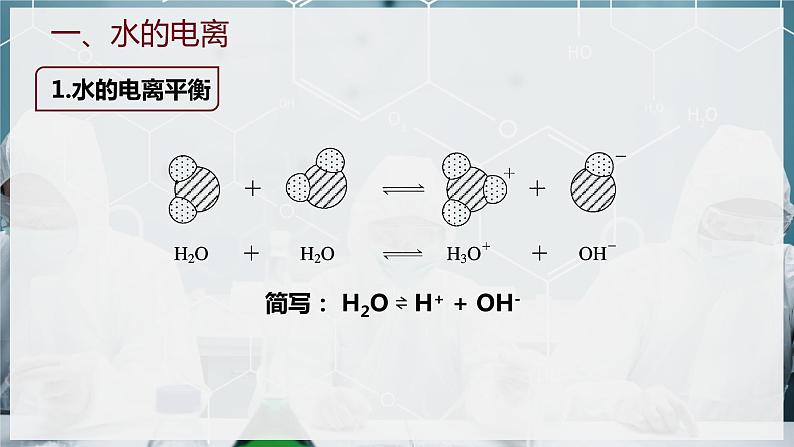
水是极弱的电解质,能发生微弱的电离
简写: H2O ⇌ H+ + OH-
H2O ⇌ H+ + OH-
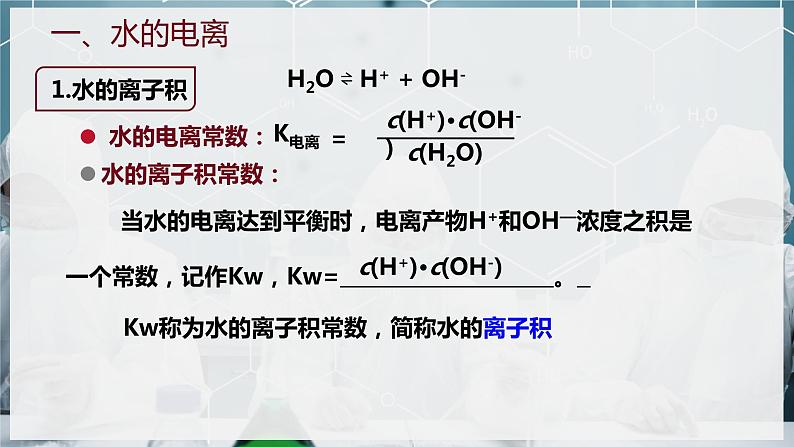
当水的电离达到平衡时,电离产物H+和OH—浓度之积是一个常数,记作Kw,Kw= 。
Kw称为水的离子积常数,简称水的离子积
c(H+)·c(OH-)
H2O ⇌ H+ + OH-
起始 55.6 0 0
1 L H2O ≈ 55.6 ml
实验测得25℃时,1L的纯水中只有1x10-7的水分子发生电离。
△ 1×10-7 1×10-7 1×10-7
平衡 55.6 1×10-7 1×10-7
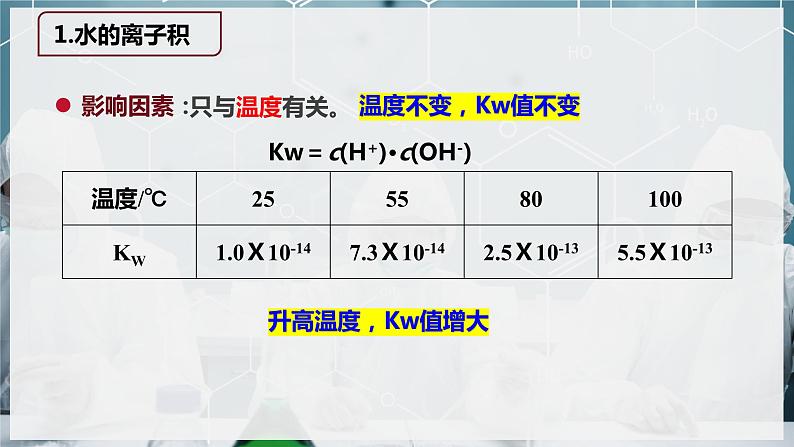
Kw =c(H+)·c(OH-)
Kw=c(H+)·c(OH-)
1.水的离子积KW只和温度有关,水电离△H>0,升温KW变大。2.在使用水的离子积时必须注明温度,否则就是陷阱。常温下(25℃)Kw=1Ⅹ10-143.水的离子积Kw不仅适用于纯水,也适用于各种酸碱盐的稀溶液。
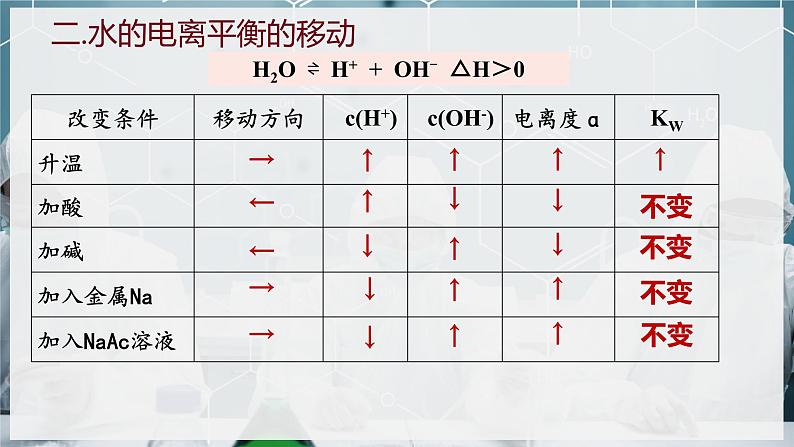
二.水的电离平衡的移动
H2O ⇌ H+ + OH- △H>0
【讨论1】酸性溶液是否有OH-存在?碱性溶液中是否有H+存在?试解释原因。
任何水溶液中,都存在水的电离平衡H2O ⇌H+ + OH-,都有H+和OH-。
25℃,酸或碱的稀溶液的密度与纯水相近,1L酸或碱的稀溶液约为1000g,其中水的物质的量近似为 ,此时,发生电离的水是否仍为纯水状态时的1.0×10-7ml?
H2O ⇌ H+ + OH-
答:纯水时发生电离的水为__________ml/L,加入酸或碱时_______________________________________________,则发生电离的水_______1.0×10-7ml/L。
增大了c(H+)或c(OH-),抑制了水的电离
在水溶液中均存在水的电离平衡,因此在表达式中,c(H+)、c(OH-)表示整个溶液总物质的量浓度,
三.水的离子积表达式的应用
Kw=c(H+)溶液·c(OH-)溶液
Kw=c(H+)水·c(OH-)水
当c(H+)酸>> c(H+)水时,可以忽略水电离出的H+
即:Kw=c(H+)酸·c(OH-)水,但水电离出来的c(H+)水= c(OH-)水
例:计算25℃,0.1ml/L的HCl溶液中, c(H+)酸= , c(OH-)水= ,c(H+)水= ,
当c(OH-)碱>> c(OH-)水时,可以忽略水电离出的OH-
即:Kw=c(H+)水·c(OH-)碱,但水电离出来的c(H+)水= c(OH-)水
例:计算25℃,0.1ml/L的NaOH溶液中,c(OH-)碱= ,c(H+)水= , c(H+)水= ,
解析:水分子中虽然H为不同的核素,但在化学性质层面来说,是完全相同的,可看作同一种物质。
1.下列关于水的叙述不正确的是( )A.水的电离是放热过程B.相同条件下海水的Kw比纯水的Kw大C.温度相同时,1H2O和2H2O分子分别构成的水的pH相同D.纯水的Kw改变时,水仍然呈中性
2.25 ℃时,水的电离达到平衡:H2O⇌H++OH- ΔH>0。下列叙述正确的是( )A.向水中加入稀氨水,平衡逆向移动,c(OH-) 降低B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变C.向水中加入少量CH3COOH,平衡逆向移动,c(H+)降低D.将水加热,Kw增大,c(H+)不变
3.25 ℃时,相同物质的量浓度的下列溶液:①NaCl;②NaOH;③H2SO4;其中水的电离程度按由大到小顺序排列的一组是( )A.③>②>①B.②>③>①C.①>②>③D.③>①>②
5.某温度下,纯水的c(H+)=2×10-7ml·L-1,则此时c(OH-)为 ml·L-1;若温度不变,滴入稀盐酸使c(H+)=0.5 ml·L-1,则溶液中c(OH-)为 ml·L-1,由水电离产生的c(H+)为 ml·L-1,此时温度 (填“高于”“低于”或“等于”)25 ℃。
高中化学人教版 (2019)选择性必修1第一节 电离平衡背景图ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡背景图ppt课件,共17页。
苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡优秀课件ppt: 这是一份苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡优秀课件ppt,共25页。PPT课件主要包含了核心素养发展目标,学习目标,交流讨论,课本84页,电离平衡常数,可表示为,由物质的本性所决定,只与温度有关,越热越电离K值越大,电离度等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡优质ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡优质ppt课件,共31页。PPT课件主要包含了复习回顾,常见的强电解质,1强酸,2强碱,“=”,常见的弱电解质,1弱酸,“⇌”,习题研究,dfh等内容,欢迎下载使用。













