




高中化学人教版 (2019)选择性必修1第一节 电离平衡评优课课件ppt
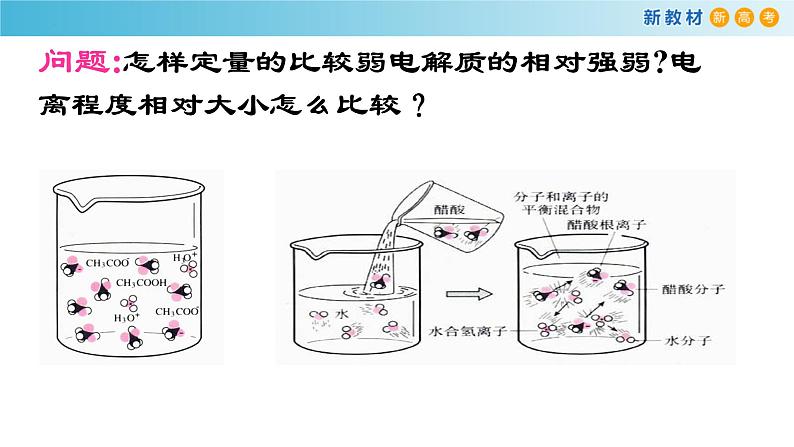
展开问题:怎样定量的比较弱电解质的相对强弱?电离程度相对大小怎么比较?
第3课时 电离平衡常数
了解电离平衡常数的含义
能从电离 离子反应等角度分析溶液的性质,如酸碱性 导电性等
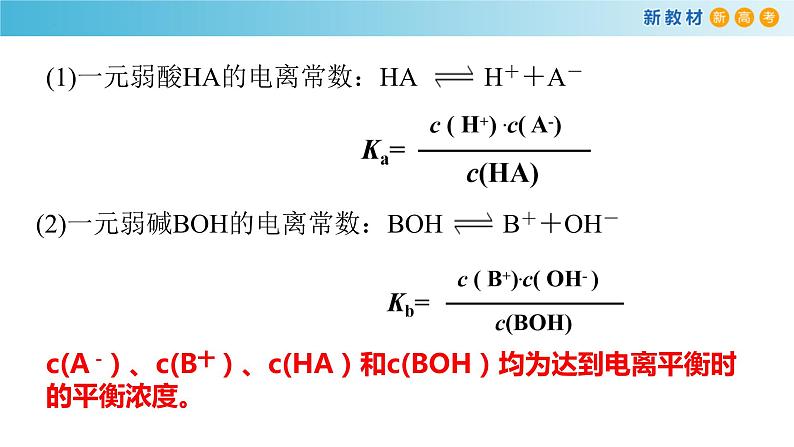
在一定条件下,当弱电解质达到电离平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,用K表示。弱酸的用Ka表示,弱碱的用Kb表示。
c(A -)、c(B十)、c(HA)和c(BOH)均为达到电离平衡时的平衡浓度。
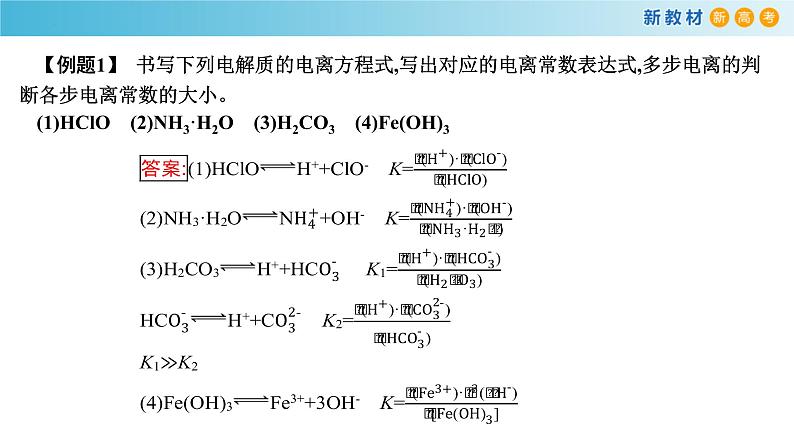
【例题1】 书写下列电解质的电离方程式,写出对应的电离常数表达式,多步电离的判断各步电离常数的大小。(1)HClO (2)NH3·H2O (3)H2CO3 (4)Fe(OH)3
【例题2】在某温度时,溶质的物质的量浓度为 0.2 ml·L−1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10−3 ml·L−1,试计算该温度下NH3·H2O的电离常数(Kb)
总结:已知起始时c(HX)和电离产生的c(H+),求电离平衡常数。 HX H+ + X- 起始: c(HX) 0 0 平衡: c(HX)-c(H+) c(H+) c(X-)
(3)多元弱酸的电离平衡常数:
多元弱酸分步电离,每一步都有电离平衡常数,通常用Ka1、Ka2等来分别表示。
25℃时H2CO3 的两步电离常数为:
H2CO3 的两步电离常数Ka1≫Ka2
H3PO4的分步电离:
多元弱酸的各级电离常数逐渐减小:
Ka1>Ka2>Ka3 ……
当Ka1≫Ka2时,计算多元弱酸中的c(H+),或比较多元弱酸酸性的相对强弱时,通常只考虑第一步电离。
25℃时,几种弱酸的电离常数
不同温度下醋酸的电离常数
分析数据,结合实验,得出结论
3.弱电解质电离平衡常数的影响因素(1)影响电离平衡常数的因素。①相同温度下,不同弱电解质的电离常数不同,即影响电离常数大小的主要因素是弱电解质本身的性质。
②弱电解质的电离常数受温度的影响,升高温度,电离平衡常数增大。
注意:电离常数大小的比较需在同一温度下进行。
3.电离常数K的影响因素:
升高温度,电离常数K值增大
电解质越弱,越难电离,电离常数K越小
同一弱电解质溶液, 电离常数K只受温度影响
在使用电离平衡常数时应指明温度
4.电离常数K的意义:
电离常数表征了弱电解质的电离能力,根据相同温度下,电离常数的大小可以判断弱电解质电离能力的相对强弱。
①弱酸的Ka越大,电离程度越大,越容易电离出H+,酸性越强。
H2SO3 > H3PO4 > HF > CH3COOH > H2CO3 > H2S > HClO > HCN
②弱碱的Kb越大,电离程度越大,越容易电离出OH-,碱性越强。
CH3COOH > HCN
电离常数由物质本性决定
Ka(CH3COOH) > Ka(HCN)
CH3COOH H+ + CH3COO−
HCN H+ +CN−
【例题3】 已知25 ℃时,相同浓度的CH3COOH溶液与HCN溶液相比较,CH3COOH溶液酸性相对更强。
你能比较该温度下CH3COOH、HCN电离常数的大小吗?
5.电离度 (α) :
弱电解质在水中达到电离平衡时,已电离的溶质分子数占原有溶质分子总数的百分数,称为电离度。
①电离度α实际上是一种平衡转化率,表示弱电解质在水中的电离程度。电离度越大,则表示弱电解质电离程度越大。
②同一弱电解质的电离度与浓度、温度有关。溶液越稀,电离度越大;温度越高,电离度越大;
6.电离常数的应用 :
⑴①比较离子浓度大小:
如磷酸溶液中离子浓度大小关系
C(H+) > c(H2PO4-) > c(HPO42-) > c(PO43-)> c(OH-)
练习1 H2S溶液和氨水中的微粒浓度大小关系分别为:
练习2.18 ℃时,H2A(酸):Ka1=4.3×10-7,Ka2=2.1×10-12;H2B(酸):Ka1=1.0×10-7,Ka2=6.3×10-13。在浓度相同的两种溶液中,用“>”“<”或“=”填空。(1)H+的浓度:H2A H2B。 (2)酸根离子的浓度:c(A2-) c(B2-)。 (3)酸分子的浓度:c(H2A) c(H2B)。 (4)溶液的导电能力:H2A H2B。
②比较弱电解质中微粒浓度比值的变化。依据弱电解质的电离常数表达式,可以比较浓度改变时(温度不变)溶液中某些微粒浓度的变化。
如:醋酸溶液中加水稀释过程中 是如何变化的?加水稀释,K值不变,c(H+)减小,则 始终保持增大。
⑵比较离子结合质子的能力大小:
弱酸的Ka值越小,酸性越弱,酸根阴离子结合H+的能力就越强。
例如:已知在25℃下,H2CO3和HClO的电离常数如下:H2CO3 的 Ka1=4.5×10-7, Ka2=4.7×10-11,HClO的Ka=3.2×10-8在Na2CO3和NaClO的混合溶液中逐滴加入稀硫酸,发生离子方程式的先后顺序为: 、 、 。 将少量CO2通入NaClO的溶液中的离子方程式: 。
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO B.少量SO2通入Ca(ClO)2溶液中: SO2+H2O+Ca2++2ClO- ═CaSO3↓+2HClO C.少量SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3- D.等浓度、体积的NaHCO3与NaHSO3混合:H++HCO3- ═ CO2↑+H2O
例题. 25℃时,弱酸的电离平衡常数如下表,下列说法正确的是( )
(3)利用电离平衡常数判断反应能否发生
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO
D.等浓度、体积的NaHCO3与NaHSO3混合:HSO3-+HCO3- ═ CO2↑+H2O+SO32-
①HB+A2- = HA-+B- ② HB+HA- = H2A+B- ③2HB+A2- = H2A+2B-
若Ka1>Ka2> Ka则能发生
④H2A+B - = HA- +HB
⑤HB+HA- = H2A+B-
⑥ HA-+B- = A2-+HB
⑦H2A+2B- = A2-+2HB
1.已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数(25 ℃)。若已知下列反应可以发生:NaCN+HNO2===HCN+NaNO2;NaCN+HF===HCN+NaF;NaNO2+HF===HNO2+NaF,由此可判断下列叙述中不正确的是( )
A.Ka(HF)=7.2×10-4B.Ka(HNO2)=4.9×10-10C.根据两个反应即可得出一元弱酸的强弱顺序为HF>HNO2>HCND.Ka(HCN)
3.部分弱酸的电离平衡常数如下表:
按要求回答下列问题:(1)HCOOH、H2S、H2CO3、HClO的酸性由强到弱的顺序为_________________________。(2)同浓度的HCOO-、HS-、S2-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为_____________________________
HCOOH>H2CO3>H2S>HClO
S2->CO32->ClO->HS->HCO3->HCOO-
(4)用电离常数判断电离平衡移动方向:
将1L 0.1 ml/L 醋酸加水稀释到2L,判断电离平衡移动的方向。
加入少量CH3COONH4
当α<1%时,c-cα ≈c
对 ①0.1ml·L-1CH3COOH ②0.01 ml·L-1的CH3COOH 溶液进行下列比较(填序号):电离度 C(H+) 酸性
高中化学人教版 (2019)选择性必修1第一节 电离平衡背景图ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡背景图ppt课件,共17页。
人教版 (2019)选择性必修1第一节 电离平衡优秀课件ppt: 这是一份人教版 (2019)选择性必修1第一节 电离平衡优秀课件ppt,共28页。PPT课件主要包含了情境导入,知识回顾,课前预习,电离平衡常数,知识精讲,思考与讨论,你知道吗,查阅资料,课堂小结,课堂检测等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 铁及其化合物优秀ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第一节 铁及其化合物优秀ppt课件,共28页。PPT课件主要包含了学习目标,加水稀释促进电离等内容,欢迎下载使用。













