



还剩21页未读,
继续阅读
所属成套资源:新人教版化学选择性必修1课件PPT全套
成套系列资料,整套一键下载
高二化学人教版(2019)选择性必修一上学期3.2.1《水的电离和溶液的pH》课件
展开
这是一份高二化学人教版(2019)选择性必修一上学期3.2.1《水的电离和溶液的pH》课件,共29页。
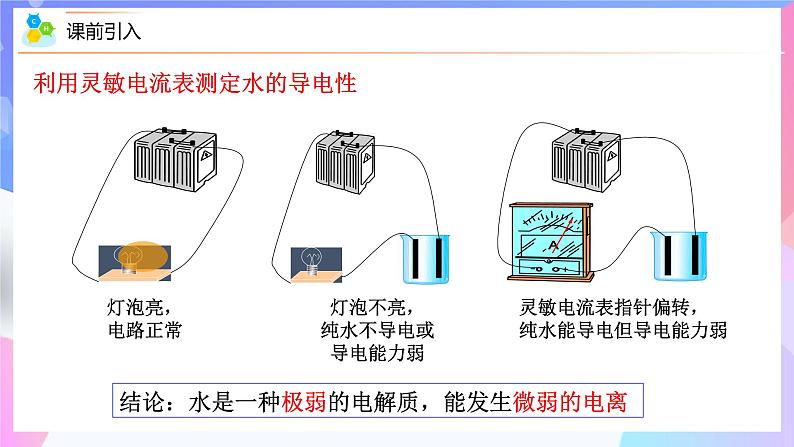
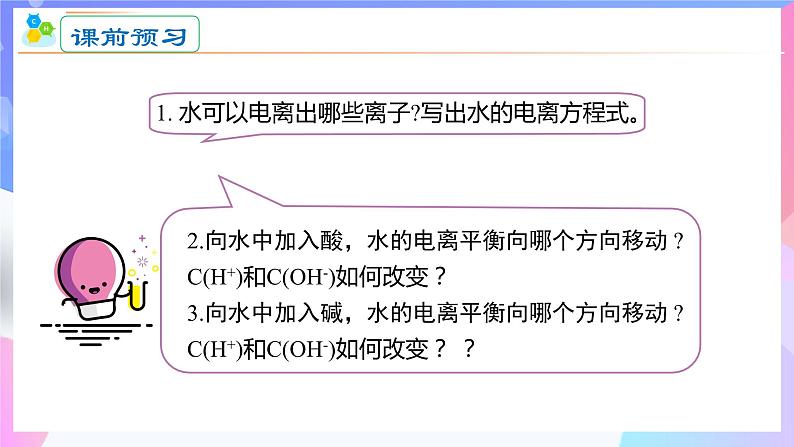
第三章 水溶液中的离子反应与平衡人教版(2019)选择性必修一 高二化学 上学期 第二节 水的电离和溶液的pH 第1课时 水的电离 情境导入高二化学教学6环节情景导入→带着问题复习及预习→根据学生情况,知识精讲→→重难点深度思考讨论/成果展示→课堂检测/成果展示→课堂小结校本教材 策划 7+4试卷负责教师 湖南——范美雄 北京——胡德华 云南—— 何雪 贵州—— 王娅娟 广西—— 罗明芳 四川—— 陈冲海 (策划,3月—找好试卷,4月—进行修改及编辑,5月—成型)选修1剩余 课件制作安排第二章 第1节 范美雄 第2节 胡德华 (第二章第1周内完成)第三章 第1节 何雪 第2节 王娅娟 第3节 罗明芳 第4节 陈冲海 (第三章第2周内完成)情境导入 在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么,其中的溶剂——水是全部以分子形式存在,还是部分以离子形式存在呢? 怎样验证你的猜想? 利用灵敏电流表测定水的导电性 灯泡亮,电路正常灯泡不亮,纯水不导电或导电能力弱灵敏电流表指针偏转,纯水能导电但导电能力弱结论:水是一种极弱的电解质,能发生微弱的电离课前预习2.向水中加入酸,水的电离平衡向哪个方向移动 ?C(H+)和C(OH-)如何改变?3.向水中加入碱,水的电离平衡向哪个方向移动 ?C(H+)和C(OH-)如何改变? ?水的电离 精确的导电性实验表明,纯水绝大部分以H2O的形式存在,但是其中存在着极少量的H3O+ 和OH-。这表明水是一种极弱的电解质,能发生微弱的电离:1.水的电离方程式:H+为裸露的质子,不稳定,容易与水结合形成H3O+(水合氢离子)知识精讲2.水的离子积常数(1)定义: 在一定温度下,当水的电离达到平衡时,电离产物H+和OH-浓度之积是一个常数,记作KW,叫做水的离子积常数,简称水的离子积。KW可由实验测得,也可以通过理论计算求得。(2)表达式: KW=c(H+)·c(OH-) 在25 ℃室温下,纯水中的c(H+)=c(OH-)=1×10-7mol·L-1, KW=1.0×10-14 水的电离知识精讲不同温度下水的离子积常数Kw只与温度有关,温度越高,Kw越大。水的离子积不仅适用于纯水,也适用于稀的电解质水溶液。①影响Kw的因素② 适用范围水的电离是吸热过程,升高温度,促进水的电离,Kw增大。Kw只与温度有关,与浓度无关。在使用Kw时一定要强调温度。3.影响水的电离平衡的因素(1) 温度:水的电离是吸热过程,升高温度,促进水电离。故升高温度,KW增大。(促进电离)↑增大增大增大=3.影响水的电离平衡的因素(2)加入酸/碱溶液或活泼金属:←减小增大增大减小C(H+)C(OH-)不变不变←→减小增大C(H+)中性碱性酸性2.溶液的酸碱性与氢离子、氢氧根离子浓度的关系(1)任何水溶液中都有H+和OH-。(2)溶液的酸碱性取决于溶液中c(H+)、c(OH-)的相对大小。= 1×10-7> 1×10-7< 1×10-7c(H+) = c(OH-)c(H+) > c(OH-)c(H+) < c(OH-)①.某溶液中c(H+)=1×10-6 mol·L-1,该溶液一定呈酸性吗?如何判断溶液的酸碱性? 提示 未指明温度,不一定呈酸性。②.在初中化学中我们用pH表示溶液的酸碱度,那么pH与c(H+)有什么关系呢? (1)pH定义:c(H+)的负对数(2)计算公式:pH=-lg c(H+)c(H+) =10-pH3.溶液的pH与c(H+)及酸碱性的关系例:c(H+)=1×10-7 mol/L 的中性溶液,pH= -lg10-7 = 7 c(H+)=1×10-5 mol/L 的酸性溶液,pH= -lg10-5 = 5 c(H+)=1×10-9 mol/L 的中性溶液,pH= -lg10-7 = 9(3) 溶液的pH、c(H+)及酸碱性的关系,如下图所示25 ℃时: pH 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 c(H+)/mol·L-110010-710-1410-210-410-1010-12中性pH适用范围中性溶液: c(H+)=c(OH-) pH=7 (25℃)酸性溶液: c(H+)>c(OH-) pH<7 (25℃)碱性溶液: c(H+)<c(OH-) pH>7 (25℃)讨论:当温度为100℃时,溶液的酸碱性和pH的关系?当c(H+)或c(OH-)>1mol/L的溶液,其酸碱性不用pH表示,而是直接用H+浓度或OH-浓度来表示。①pH适用于c(H+) 或 c(OH-)≤1mol/L的溶液的酸碱性表示,常温时pH的范围0—14。② c(H+)越大,pH越小,酸性越强。③pH等于7,仅为常温时溶液是否是中性的判断依据。4 .溶液酸碱性的测定方法①利用pH试纸测定使用方法:取一小段pH试纸于干燥洁净的玻璃片(或表面皿)上, 用干燥洁净的玻璃棒蘸取待测液点在试纸的中央,当试纸颜色变化稳定后与标准比色卡对照,读出pH。类型:广泛pH试纸(最常用) 、精密pH试纸、 专用pH试纸。pH范围:1~14可识别的pH差:约为1pH范围:较窄可识别的pH差:0.2或0.3(1)pH试纸使用前能否用蒸馏水润湿?若用湿润的pH试纸测量溶液的pH对结果有何影响?不能用湿润的玻璃棒蘸取待测液,也不能将pH试纸先用水润湿,否则会将溶液稀释,可能导致所测定的pH不准确,使酸性溶液的pH变大,碱性溶液的pH变小,但中性溶液不受影响。不能将试纸伸到溶液中。若某溶液具有漂白性,则不能用酸碱指示剂测定该溶液的酸碱性,也不能用pH试纸测定其pH。(2)某同学用pH试纸测量新制氯水的pH为1.0,他的结论正确吗?测溶液pH时的三注意(3)pH试纸不能测c(H+)或c(OH-)>1 mol·L-1的溶液的pH。②用pH计测定(准确读数)pH计,又叫 ,可用来精密测量溶液的pH,其量程为 。可识别的pH差:0.01。酸度计0~14③酸碱指示剂法(只能测定溶液的pH范围)红紫蓝无浅红红红橙黄工农业生产和科学实验中常常涉及溶液的酸碱性,人们的生活和健康也与溶液的酸碱性有密切关系。因此,测试和调控溶液的pH, 对工农业生产、科学研究,以及日常生活和医疗保健等都具有重要意义。5.pH的应用【思考】为了保证正常生理活动,人体各种体液的酸碱度都要维持在一定范围。血浆中的H2CO3/HCO3-缓冲体系对稳定体系的酸碱度发挥着重要作用。请解释H2CO3/HCO3-对体液酸碱度的缓冲作用:当体系中增加少量强酸时,平衡向正反应方向移动而消耗H+; 当增加少量强碱时,平衡向逆反应方向移动而消耗OH-。因此,可以防止体系的酸碱度出现较大幅度的变化。【练1】下列溶液一定显酸性的是( )A. 溶液中c(OH-)> c(H+) B. 滴加紫色石蕊容易后变红色的溶液C. 溶液中 c(H+)=6×10-7mol/L D. pH<7的溶液【练1】常温下,下列溶液中碱性最强的是( )A. pH=11的溶液 B. c(OH-)=0.12mol/LC.1L中溶有 4gNaOH 的纯溶液 D. c(H+)=1×10-10mol/L的溶液BB课程结束人教版(2019)选择性必修一 高二化学上学期第三章第二节
第三章 水溶液中的离子反应与平衡人教版(2019)选择性必修一 高二化学 上学期 第二节 水的电离和溶液的pH 第1课时 水的电离 情境导入高二化学教学6环节情景导入→带着问题复习及预习→根据学生情况,知识精讲→→重难点深度思考讨论/成果展示→课堂检测/成果展示→课堂小结校本教材 策划 7+4试卷负责教师 湖南——范美雄 北京——胡德华 云南—— 何雪 贵州—— 王娅娟 广西—— 罗明芳 四川—— 陈冲海 (策划,3月—找好试卷,4月—进行修改及编辑,5月—成型)选修1剩余 课件制作安排第二章 第1节 范美雄 第2节 胡德华 (第二章第1周内完成)第三章 第1节 何雪 第2节 王娅娟 第3节 罗明芳 第4节 陈冲海 (第三章第2周内完成)情境导入 在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么,其中的溶剂——水是全部以分子形式存在,还是部分以离子形式存在呢? 怎样验证你的猜想? 利用灵敏电流表测定水的导电性 灯泡亮,电路正常灯泡不亮,纯水不导电或导电能力弱灵敏电流表指针偏转,纯水能导电但导电能力弱结论:水是一种极弱的电解质,能发生微弱的电离课前预习2.向水中加入酸,水的电离平衡向哪个方向移动 ?C(H+)和C(OH-)如何改变?3.向水中加入碱,水的电离平衡向哪个方向移动 ?C(H+)和C(OH-)如何改变? ?水的电离 精确的导电性实验表明,纯水绝大部分以H2O的形式存在,但是其中存在着极少量的H3O+ 和OH-。这表明水是一种极弱的电解质,能发生微弱的电离:1.水的电离方程式:H+为裸露的质子,不稳定,容易与水结合形成H3O+(水合氢离子)知识精讲2.水的离子积常数(1)定义: 在一定温度下,当水的电离达到平衡时,电离产物H+和OH-浓度之积是一个常数,记作KW,叫做水的离子积常数,简称水的离子积。KW可由实验测得,也可以通过理论计算求得。(2)表达式: KW=c(H+)·c(OH-) 在25 ℃室温下,纯水中的c(H+)=c(OH-)=1×10-7mol·L-1, KW=1.0×10-14 水的电离知识精讲不同温度下水的离子积常数Kw只与温度有关,温度越高,Kw越大。水的离子积不仅适用于纯水,也适用于稀的电解质水溶液。①影响Kw的因素② 适用范围水的电离是吸热过程,升高温度,促进水的电离,Kw增大。Kw只与温度有关,与浓度无关。在使用Kw时一定要强调温度。3.影响水的电离平衡的因素(1) 温度:水的电离是吸热过程,升高温度,促进水电离。故升高温度,KW增大。(促进电离)↑增大增大增大=3.影响水的电离平衡的因素(2)加入酸/碱溶液或活泼金属:←减小增大增大减小C(H+)
相关资料
更多









