







人教版 (2019)必修 第二册第三节 乙醇与乙酸一等奖ppt课件
展开高中化学新教材特点分析及教学策略
(一)化学基本概念和化学基本理论:全套教材的知识安排,注意各年级内及各年级间的联系,在保证知识结构的系统性和完整性的同时,对内容的安排采用了将各部分知识分散处理,相对集中的方法。
(二)元素化合物知识:关于元素化合物知识,高一教材首先介绍了碱金属和卤素两个最典型的金属族和非金属族。
(三)化工基础知识:高一介绍了硅酸盐工业和环境保护知识。高二主要介绍合成氨工业,删掉了硝酸工业、钢铁工业和铝的冶炼。重点突出了合成氨工业中合成氨条件的选择。
一、烃的衍生物
1.定义:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。
2.示例:CH3Cl可以看做是CH4中的一个氢原子被氯原子取代生成的;CH3OH可以看做是CH4中的一个氢原子被—OH取代生成的。
二、官能团
1.定义:决定有机化合物特性的原子或原子团。
2.示例:
物质 | CH3Cl | CH2 = CH2 |
| CH3OH | CH3COOH |
官能团 | —Cl |
| —OH | —COOH | |
官能团名称 | 氯原子 | 碳碳双键 | 碳碳三键 | 羟基 | 羧基 |
思考与交流——羟基(-OH)与氢氧根(OH-)有什么区别?
名称 | 氢氧根(OH-) | 羟基(-OH) |
电子式 | (10电子) | (9电子) |
电性 | 带负电的阴离子 | 电中性 |
稳定性 | 稳定 | 不稳定 |
能否独立存在 | 能独立存在于溶液或离子化合物中 | 不能独立存在,必须和其他基团或原子结合 |
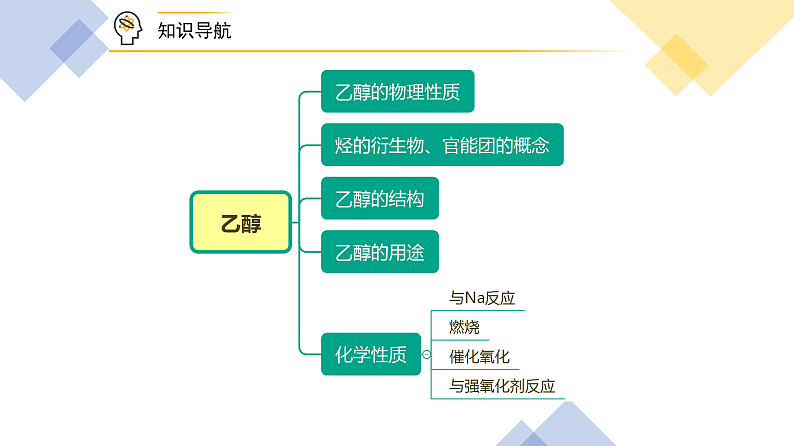
三、乙醇的物理性质
颜色 | 气味 | 挥发性 | 状态 | 密度 | 溶解性 |
无色透明 | 特殊香味 | 易挥发 | 液体 | 比水小 | 与水以任意比互溶 |
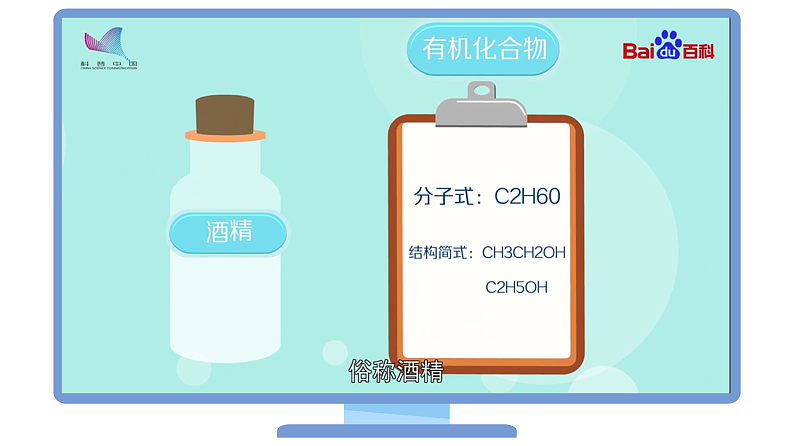
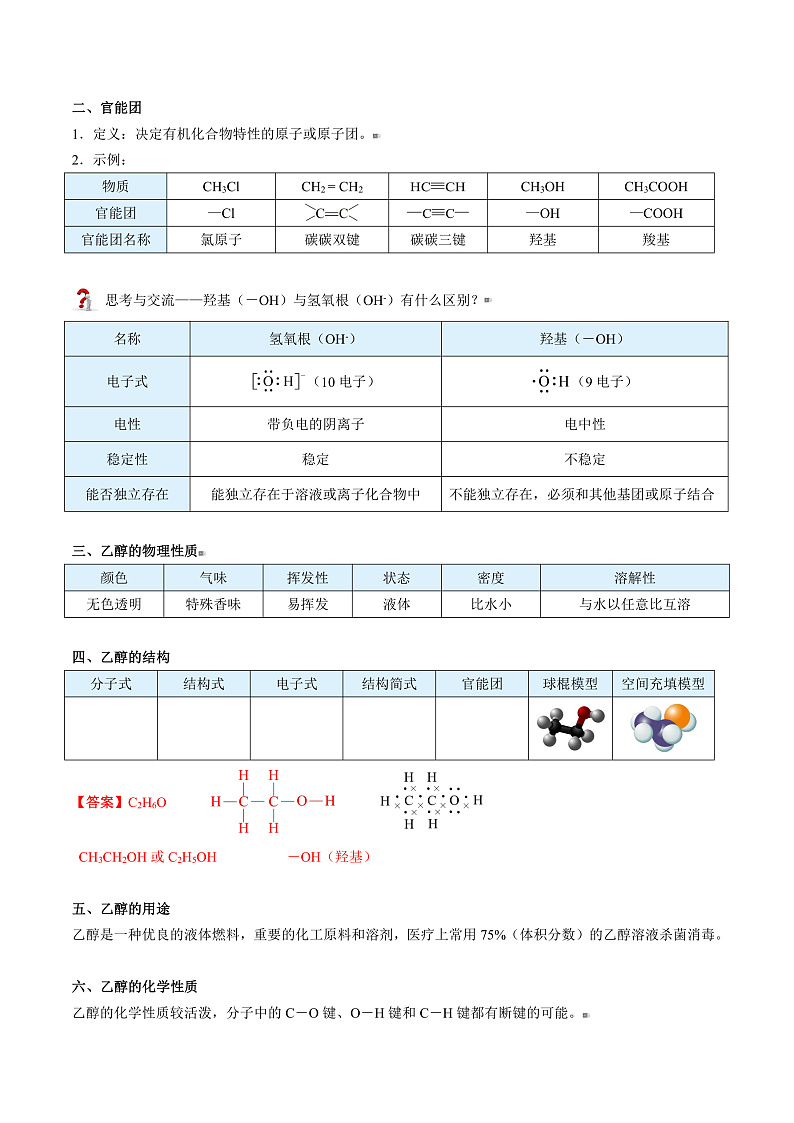
四、乙醇的结构
分子式 | 结构式 | 电子式 | 结构简式 | 官能团 | 球棍模型 | 空间充填模型 |
|
|
|
|
|
五、乙醇的用途
乙醇是一种优良的液体燃料,重要的化工原料和溶剂,医疗上常用75%(体积分数)的乙醇溶液杀菌消毒。
六、乙醇的化学性质
乙醇的化学性质较活泼,分子中的C-O键、O-H键和C-H键都有断键的可能。
1.乙醇与金属钠的反应
实验操作 | 在盛有少量无水乙醇的试管中,加入一小块新切的、用滤纸吸干表面煤油的钠,在试管口迅速塞上带尖嘴导管的橡胶塞,用小试管收集气体并检验其纯度,然后点燃,再将干燥的小烧杯罩在火焰上。待烧杯璧上出现液滴后,迅速倒转烧杯,向其中加入少量澄清石灰水。 | |
实验现象 | 钠沉于无水乙醇的底部,表面有气泡产生,慢慢消失;放出的气体可在空气中安静地燃烧,火焰呈淡蓝色;烧杯壁上有水珠生成;澄清石灰水未变浑浊。 | |
实验结论 | 金属钠置换了乙醇中羟基上的氢,生成氢气和乙醇钠 2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑ | |
思考与交流
2.氧化反应
(1)乙醇的燃烧
乙醇在空气中燃烧时,火焰呈淡蓝色,放出大量的热。化学方程式为:
______________________________________________________________
(2)乙醇的催化氧化
实验操作 | 向试管中加入少量乙醇,取一根铜丝,下端绕成螺旋状,在酒精灯上灼烧后插入乙醇,反复几次。注意观察反应现象,小心地闻试管中液体产生的气味。 | |
实验现象 | 在酒精灯上加热时铜丝由红色变黑,插入乙醇后铜丝又由黑变红色。 试管中液体有刺激性气味。 | |
实验原理 | 2Cu+O22CuO (铜丝变黑) (铜丝由黑变红) | |
实验结论 | 乙醇在加热和催化剂(Cu或Ag)存在的条件下,被空气中的氧气氧化成乙醛。 总反应:____________________________________________________________ | |
(3)乙醇与强氧化剂的反应
反应原理 | |
实验现象 | (1)酸性高锰酸钾溶液紫色褪去 (2)酸性重铬酸钾溶液由橙色()变为绿色(Cr3+) |
题型一:乙醇的物理性质
【例1】下列有关乙醇的物理性质的应用中不正确的是
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分
C.乙醇能够与水以任意比例互溶
D.由于乙醇容易挥发,所以才有俗语“酒香不怕巷子深”的说法
题型二:乙醇的结构
【变2-1】能证明乙醇分子中含有一个羟基的事实是 ( )
A.乙醇容易挥发 B.乙醇能与水以任意比例互溶
C.乙醇完全燃烧生成CO2和H2O D.0.1 mol乙醇与足量Na反应生成 0.05 mol H2
题型三:乙醇与钠的反应
【例3】向装有乙醇的烧杯中投入一小块金属钠,下列对该实验现象的描述正确的是
A.钠块浮在乙醇的上面
B.钠块熔化成小球
C.钠块在乙醇的液面上游动
D.钠块表面有气体放出
【变4】A、B、C三种醇分别与足量的金属钠完全反应,在相同条件下产生相同的体积,消耗这三种醇的物质的量之比为3:6:2,则A、B、C三种醇分子中所含羟基的个数之比为
A.3:2:1 B.2:6:3 C.3:1:2 D.2:1:3
题型四:乙醇的氧化
【例5】一定质量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6 g,若其中水的质量为10.8 g,则CO的质量是
A.4.4 g B.1.4 g
C.2.2 g D.在2.2 g和4.4 g之间
【变6】乙醇氧化制乙醛的实验装置如图所示(夹持仪器和加热仪器均未画出),下列叙述错误的是( )
A.a中所盛放的固体可以是CuO
B.d中乙醇可用沸水浴加热
C.c中具支试管b中有无色液体产生
D.c中具支试管b可换成带塞的普通试管
【例8】酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此测定原理有关的是
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧化合物
A.②④ B.②③ C.①③ D.①④
题型五:乙醇的性质综合
【变10】乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )
A.和金属钠反应时键①断裂
B.在铜催化共热下与O2反应时断裂①和③键
C.在铜催化共热下与O2反应时断裂①和⑤键
D.在空气中完全燃烧时断裂①②③④⑤键
【例11】“对酒当歌,人生几何”“劝君更进一杯酒,西出阳关无故人”“何以解忧,唯有杜康”等有关于酒的中国古诗词比比皆是,在历史长河中酒不仅是一种具体的物质,而且成了一种文化的象征。酒的主要成分是一种常见的有机物乙醇。
(1)乙醇是无色有特殊香味的液体,密度比水的______。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为________________________(不写反应条件)。
(3)属于乙醇的同分异构体的是________(填字母)。
A. B.
C.甲醇 D.CH3—O—CH3
E.HO—CH2CH2—OH
(4)乙醇能够发生氧化反应:
①46 g乙醇完全燃烧消耗________mol氧气。
②乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为_______________。
(5)乙醇和金属钠缓慢的反应,放出无色无味的气体,反应的方程式为__________________。
【题1】如图是一种生活中常见有机物的球棍模型。关于该物质的说法正确的是
A.分子式为C3H6 B.含有氢氧根离子,水溶液呈碱性
C.能电离出氢离子,水溶液呈酸性 D.能与金属钠反应放出氢气
【题2】类比乙烯和乙醇的化学性质,推测丙烯醇(CH2=CH—CH2OH)不可发生的化学反应有( )
A.加成反应 B.聚合反应
C.取代反应 D.与Na2CO3溶液反应放出CO2
【题3】催化氧化产物是的醇是
A. B.
C. D.
【题4】在探究乙醇的有关实验中,得出的结论正确的是
选项 | 实验步骤及现象 | 实验结论 |
A | 在酒精试样中加入少量CuSO4·5H2O,搅拌,试管底部有蓝色晶体 | 酒精试样中一定含有水 |
B | 在乙醇燃烧火焰上方罩一冷的干燥烧杯,内壁有水珠出现,另罩一内壁涂有澄清石灰水的烧杯,内壁出现白色沉淀 | 乙醇由C、H、O三种元素组成 |
C | 将灼热后表面变黑的螺旋状铜丝伸入约50℃的乙醇中,铜丝能保持红热一段时间 | 乙醇催化氧化反应是放热反应 |
D | 在0.01mol金属钠中加入过量的乙醇充分反应,收集到标准状况下气体112mL | 乙醇分子中有1个氢原子与氧原子相连,其余与碳原子相连 |
A.A B.B C.C D.D
【题5】已知C4H10的同分异构体有两种:CH3–CH2–CH2–CH3、,则C4H9OH属于醇类的同分异构体共有
A.3种 B.4种 C.l种 D.2种
【题6】将0.1mol有机化合物A与标准状况下5.6L氧气混合,一定条件下两者完全反应,只有CO、CO2和H2O三种产物,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重5.4g,碱石灰增重4.4g,还有标准状况下2.24L气体的剩余,求:
(1)有机化合物A的分子式___________;
(2)若有机化合物A能与钠反应放出氢气,请写出A的结构简式___________;
(3)写出所有比A多一个—CH2—原子团的同系物的结构简式___________。
【题7】如图是A分子的球棍模型和B分子的比例模型,回答下列问题:
(1)A和B的关系是___________。
(2)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式_____________。
(3)写出B分子和金属钠反应的化学方程式___________________。
(4)B在加热条件下能够和HBr发生反应生成溴乙烷,该反应类型是_________。
【练1】下列说法中正确的是
A.乙醇分子中有—OH基团,所以乙醇溶于水后溶液显碱性
B.乙醇与钠反应可以产生氢气,所以乙醇溶于水后溶液显酸性
C.乙醇在空气中燃烧生成二氧化碳和水,说明乙醇分子中含有C、H、O三种元素
D.乙醇羟基中的氢原子比乙烷中的氢原子活泼
【练2】有机物Ⅰ和Ⅱ的结构式如下,下列说法中不正确的是( )。
A.Ⅰ和Ⅱ是同分异构体
B.Ⅰ和Ⅱ物理性质有所不同
C.Ⅰ和Ⅱ化学性质相同
D.Ⅰ和Ⅱ含12C的质量分数相同
【练3】下列说法正确的是( )
①检测乙醇中是否含有水可加入少量的无水硫酸铜,若变蓝则说明含水
②除去乙醇中微量的水可加入金属钠,使其完全反应
③加热蒸馏含水的乙醇可获得无水乙醇
④在含少量水的乙醇中加入生石灰,然后再加热蒸馏可以获得无水乙醇
A.①③ B.②④ C.①④ D.③④
【练4】以下化学用语不正确的是
A.乙醇的空间充填模型为 B.乙醇的分子式为C2H6O
C.乙醇的结构简式为CH3CH2OH D.羟基的电子式为
【练5】向装有乙醇的烧杯中投入一小块金属钠,下列对实验现象的描述中正确的是( )
A.钠块沉在乙醇液面之下
B.钠块熔化成小球
C.钠块在乙醇的液面上游动
D.向烧杯中滴入几滴酚酞溶液变红色
【练6】已知有如下转化关系:CH3CHOC2H5OHC2H4C2H5Br;则反应①、②、③的反应类型分别为
A.取代、加成、取代 B.取代、取代、加成
C.氧化、加成、加成 D.氧化、取代、取代
【练7】某化学反应过程如图所示,由下图得出的判断,错误的是
A.乙醇发生了还原反应
B.反应中有红黑颜色交替变化的现象
C.铜是此反应的催化剂
D.生成物是乙醛
【练8】乙醇是生活中常见的有机物,能进行如下图所示的多种反应,A、C都是有机物。
写出下列反应的化学方程式:
①______________________;
②_________________________;
③___________________________。
高中化学人教版 (2019)必修 第二册第七章 有机化合物第三节 乙醇与乙酸教案配套ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第七章 有机化合物第三节 乙醇与乙酸教案配套ppt课件,共52页。PPT课件主要包含了第三节乙醇与乙酸,第1课时乙醇,新课情景呈现,课前素能奠基,易挥发,C2H6O,CH3CH2OH,C2H5OH,氢原子,碳碳双键等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第三节 乙醇与乙酸课文ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第三节 乙醇与乙酸课文ppt课件,共35页。
高中化学人教版 (2019)必修 第二册第七章 有机化合物第三节 乙醇与乙酸精品ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第七章 有机化合物第三节 乙醇与乙酸精品ppt课件,文件包含高中化学新教材同步必修第二册第22讲乙醇与乙酸三官能团与有机化合物的分类PPT课件pptx、高中化学新教材同步必修第一册第22讲乙醇与乙酸三官能团与有机化合物的分类教师版docx、高中化学新教材同步必修第一册第22讲乙醇与乙酸三官能团与有机化合物的分类学生版docx等3份课件配套教学资源,其中PPT共14页, 欢迎下载使用。













