





第五章 第二节 第3课时 硝酸 酸雨及其防治(课件PPT+同步练习)
展开课时把关练
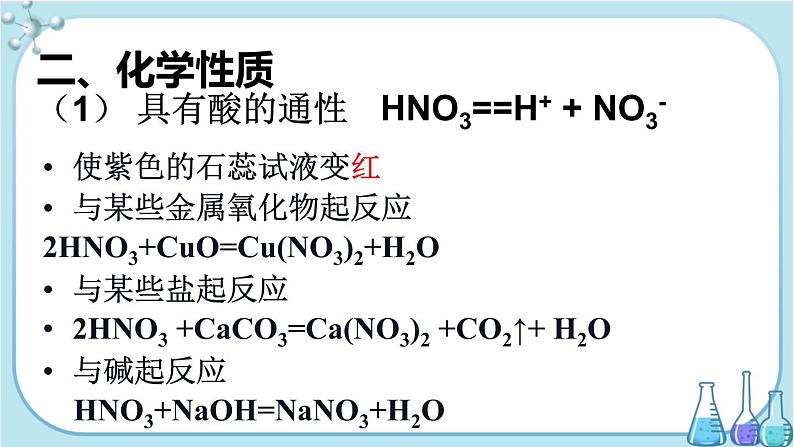
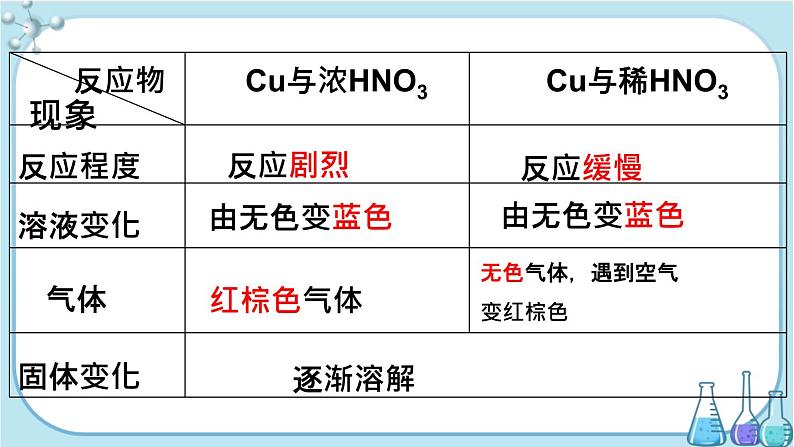
第二节 氮及其化合物
第3课时 硝酸
1.下列有关硝酸化学性质的叙述中,正确的是( )
A.稀硝酸使红色石蕊试纸变蓝
B.稀硝酸和浓硝酸均有强氧化性,且稀硝酸的
氧化性强于浓硝酸
C.硝酸可与Na2S反应制得H2S气体
D.浓硝酸因分解放出的NO2又溶解于硝酸而呈
黄色
2.木炭与浓HNO3共热,产生的气体X等分为①和②两份,将两份气体分别按图实验:
则澄清石灰水的变化可能是( )
A.①不变浑浊,②变为乳白色浑浊
B.①、②都不变浑浊
C.①变为乳白色浑浊,②不变浑浊
D.①、②均变为乳白色浑浊
3.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL C.30 mL D.15 mL
4.向200 mL稀硫酸和稀硝酸的混合溶液中缓慢加入铁粉,产生气体的体积随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列说法错误的是( )
A.OA段产生的气体是NO,BC段产生的气体是H2
B.A点溶液中的溶质为Fe2(SO4)3和H2SO4
C.原混合溶液中NO3-的物质的量为0.2 mol
D.原混合溶液中H2SO4的物质的量浓度为1 mol/L
5.铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境。为使实验的设计符合绿色化学的思想,某兴趣小组设计出如图所示装置来改进“铜与硝酸反应”的实验,以探究化学实验的绿色化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是 。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是 ,。再由a向c中加2 mL蒸馏水,c中的实验现象是 。
(3)表中是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 ,理由是 。
方案 | 反应物 |
甲 | Cu、浓硝酸 |
乙 | Cu、稀硝酸 |
丙 | Cu、O2、稀硝酸 |
(4)该兴趣小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,操作步骤为 ,实验现象为 ;但此实验的不足之处是 。
课时把关练
第二节 氮及其化合物
第3课时 硝酸
参考答案
1.D
2.C
3.A
4.D
5.(1)检查装置气密性
(2)Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O 反应变慢,气体颜色变淡
(3)丙 硝酸耗量少,无污染
(4)向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸 c中有黄绿色气体产生,d中溶液变棕黄色 没有尾气吸收装置









