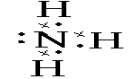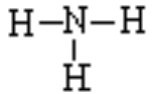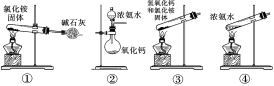




人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第二节 氮及其化合物获奖课件ppt
展开《氮及其化合物》第二课时教学设计
课题 | 《氮及其化合物》第二课时 | 单元 | 5 | 学科 | 化学 | 年级 | 高一 |
教材 分析 | 本节教学内容是人教版高中化学必修第二册第五章《化工生产中的重要非金属元素》第二节《氮及其化合物》的第二课时。本节内容是典型的元素化合物知识,这一课时的教学内容主要是氨和铵盐的性质。教材通过浓硝酸的的颜色以及氨的喷泉实验,让我们认识氨的的结构和性质。氨及铵盐是氮组元素的重要组成部分。氨就是我们身边的元素,我们身边的化肥以及身体中,都有氨及铵盐的影子,通过氨的喷泉实验,引出氨的化学性质,然后通过观察思考、实验探 另外,在氨以及铵盐的生产制造过程中,产生了大气污染物。我们要严格遵循新课程标准“关注人类面临的与化学相关的问题,培养学生的社会责任感、参与意识和决策能力”的要求,加强环境教育,关注环境问题,要对我们的社会负责,也要对我们的环境负责。在介绍氨以及铵盐的性质与应用时,不止看到化学对我们带来的好处,也要关注化学对我们带来的负面效果。而解决环境问题,最终的还要从化学学科入手,找到解决的根本方法。我们一定要培养学生科学的学习态度和方法,为解决我们的黄精问题,尽自己的一份力量。 本节安排了“氨-----NH3”,“铵盐”,这两部分内容。学生通过学习这部分知识,掌握氮的氨以及铵盐有关的化学性质。 | ||||||
教学目标与核心素养 | 宏观辨识与微观探析:通过氮喷泉实验,了解氨水的化学性质,同事要了解喷泉实验的原理;对于铵盐,使我们农作物的一种重要的氮肥,要认识铵盐在农业生成中的重要作用,对于铵盐的使用,要注意使用安全。 证据推理与模型认知:通过观察喷泉实验,提高获取知识、分析知识、评价知识的能力,通过结构与性质之间的关系激发学生学习化学的兴趣。。 科学探究与创新意识:从现象和结构出发,设计探究方案,探究喷泉实验的原理,在探究中互利合作,培养团队精神。 科学精神与社会责任:激发学生透过现象探究本质的兴趣,尊重科学,认真学习科学的学习方法;通过参与探究过程,培养自身严谨的科学态度和辩证分析能力。同时,我们也要注重化学知识在现实生活中的应用,注重理论联系实际。 | ||||||
重点 难点 | 氨和铵盐的化学性质。 | ||||||
教学过程 |
教学环节 | 教师活动 | 学生活动 | 设计意图 |
导入新课 | 我们经常在城市的广场上看到美丽的喷泉,那么你知道,在实验室里也可以形成美丽的喷泉吗?这一节课,我们就讲一种可以形成喷泉的物质---NH3。 |
|
|
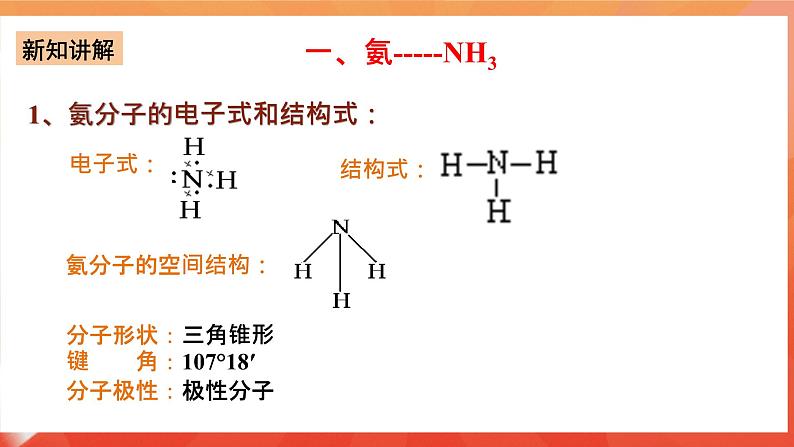
讲授新课 | 第一节 氮及其化合物 一、氨-----NH3 1、氨分子的电子式和结构式:
电子式:
结构式:
氨分子的空间结构:
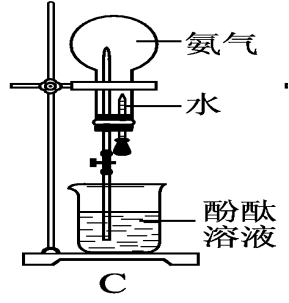
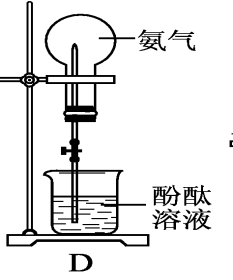
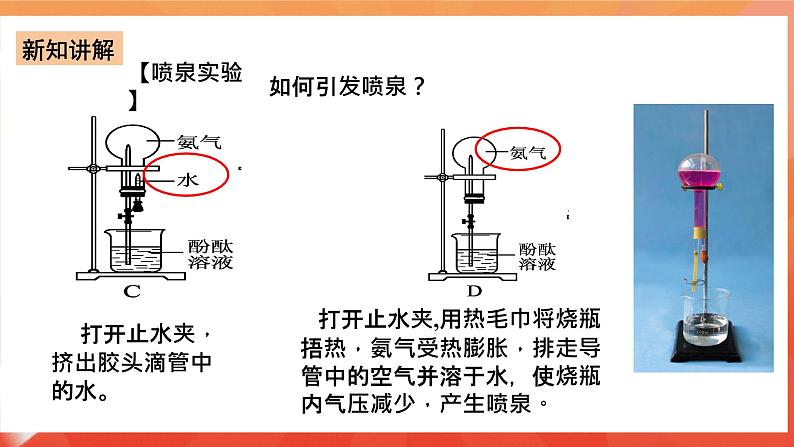
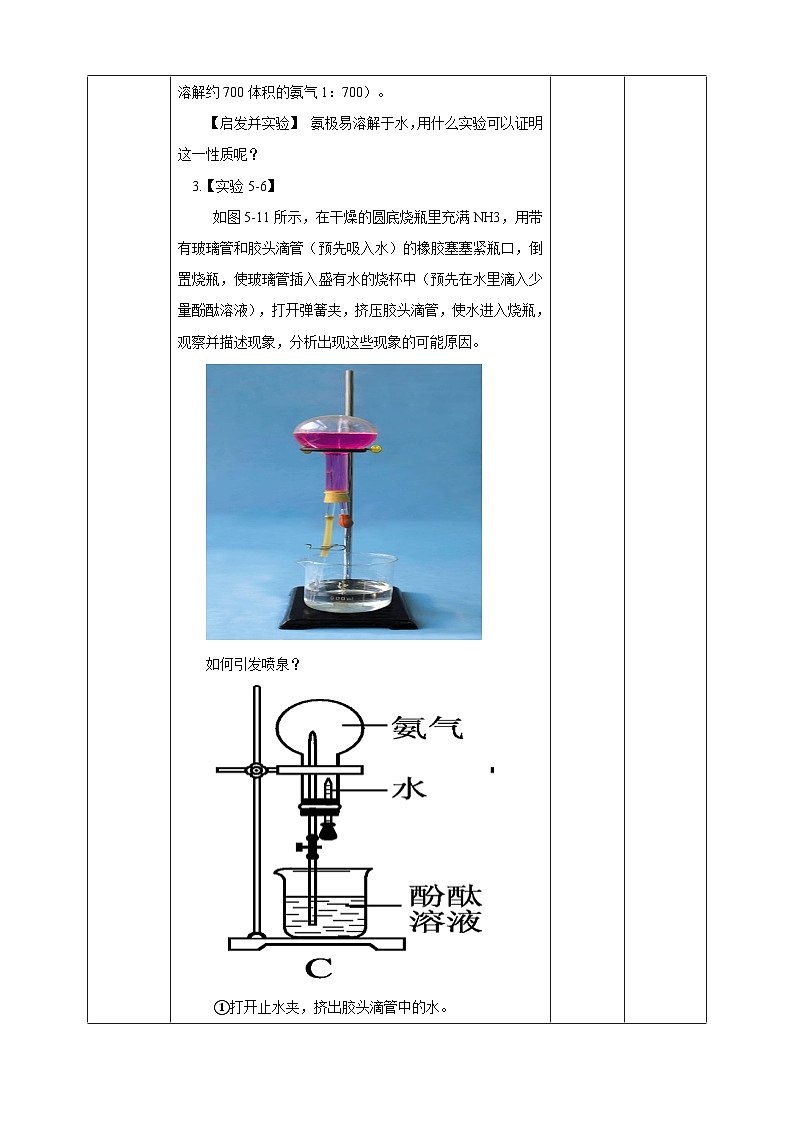
分子形状:三角锥形 键 角:107°18′ 分子极性:极性分子 2、物理性质 无色、有刺激性气味;密度比空气小,标准状况下密度0.771g/L;易液化,(可作致冷剂);极易溶于水(1体积水溶解约700体积的氨气1:700)。 【启发并实验】 氨极易溶解于水,用什么实验可以证明这一性质呢? 3.【实验5-6】 如图5-11所示,在干燥的圆底烧瓶里充满NH3,用带有玻璃管和胶头滴管(预先吸入水)的橡胶塞塞紧瓶口,倒置烧瓶,使玻璃管插入盛有水的烧杯中(预先在水里滴入少量酚酞溶液),打开弹簧夹,挤压胶头滴管,使水进入烧瓶,观察并描述现象,分析出现这些现象的可能原因。
如何引发喷泉?
①打开止水夹,挤出胶头滴管中的水。
②打开止水夹,用热毛巾将烧瓶捂热,氨气受热膨胀,排走导管中的空气并溶于水,使烧瓶内气压减少,产生喷泉。 ③城市中常见的人造喷泉及火山爆发的原理与上述的原理相似吗?
想想看:(1)氨为什么会形成喷泉(该实验的原理)?氨极易溶于水,使烧瓶内外形成较大的压差; (2)溶液为什么变为红色?氨气溶于水溶液显碱性。 (3)实验成败的关键是什么? a.烧瓶干燥; b.装置的气密性好;c.收集的气体纯度尽可能高。 4.氨水 (1)氨气溶于水时 (氨气的水溶液叫氨水),大部分的NH3分子与H2O分子结合成NH3·H2O(一水合氨)。NH3·H2O是弱碱,为弱电解质,可以部分电离。NH3·H2O能使酚酞溶液变红或者使红色的石蕊试纸变蓝 。 氨水具有弱碱性,具有碱的通性 NH3·H2O能使酚酞溶液变红或者使红色的石蕊试纸变蓝,用此来检验氨气的存在。 (2)氨水的化学性质: ①氨与水的反应: NH3+H2O ↔ NH3.H2O ↔ NH4++OH- 问题:氨水中含有哪几种微粒? 分子:NH3、H2O、NH3·H2O 离子:NH4+、OH-、H+
NH3·H2O NH3↑+ H2O
5..氨跟酸的反应 演 示 实 验----氨与氯化氢反应 NH3+HCl = NH4Cl NH3+HNO3 = NH4NO3 有白烟生成,可用来检验氨气或氯化氢是否泄漏。 2NH3+H2SO4 = (NH4)2SO4为什么没有白烟?因为硫酸是非挥发性酸。
氨中N为-3价,具有还原性。
2NH3 + 3Cl2 == N2 + 6HCl(少量氨气)
2NH3 + 3CuO N2 + 3Cu +3 H2O
7、氨的用途和保存,(观看PPT) 氨水的保存方法:氨水对许多金属有腐蚀作用,所以 不能用金属容器盛装氨水。通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里。 二. 铵盐 1.铵盐是NH4+和酸根离子组成的化合物。铵盐都是晶体,易溶于水。 2.常见铵盐: 硫酸铵【(NH4)2SO4 ,俗称硫铵,又称肥粉】; 氯化铵【NH4Cl,俗称氯铵】; 硝酸铵【NH4NO3,俗称硝铵、炸药】; 碳酸氢铵【NH4HCO3,俗称碳铵】 铵盐属于铵态氮肥。 常用氮肥有铵态氮肥和尿素【 CO(NH2)2 】
NH4Cl NH3 ↑ + HCl↑
NH4HCO3 NH3 ↑ + CO2↑ + H2O↑
(NH4)2CO3 2NH3 ↑ + CO2↑ + H2O↑
注意:并不是所有铵盐分解都产生氨气 NH4NO3在400 ℃以上分解生成N2、NO2和H2O
应用:用来制取氨气以及NH4+的检验
向盛有向盛有少量氯NH4Cl2溶液、(NH4)2SO4溶液,NH4NO3溶液的三支试管中,分别加入氢氧化钠溶液并加热(注意通风),用镊子夹住一片湿润的红色石蕊试纸放在试管口,观察现象,分析现象产生的原因,写出反应的离子方程式。
反应的方程式:NH4Cl+NaOH====NaCl+NH3↑+H2O
NH4NO3+NaOH====NaNO3+NH3↑+H2O
(NH4)2SO4+2NaOH====Na2SO4+2NH3↑+2H2O
NH4 + + OH- NH3 ↑ + H2O
利用铵盐的这个性质常用来制取氨气和检验铵根离子的存在。
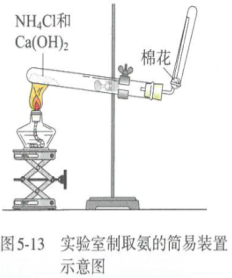
(1)检验某白色固体是否为铵盐的方法 ①少许样品和碱混合于试管中加热,将湿润的红色石蕊试纸靠近试管口,若试纸变蓝色,则证明样品中含铵盐(NH4+)。 ②取少许样品和碱混合于试管中共热,用蘸有浓盐酸的玻璃棒检验产生的气体,若有白烟产生,则证明样品中含铵盐(NH4+)。 (2)检验无色溶液中是否存在NH4+的方法 将待检物取出少量置于试管中,加入NaOH溶液后,加 热,用湿润的红色石蕊试纸在管口检验,若试纸变蓝色,则证明待检物中含铵盐(NH4+)。 6.氨气的实验室制法 【思考与讨论】 图5-13为实验室制取氨的简易装置示意图。请仔细观察实验装置,思考如何试管中已收集满氨,如何吸收处理实验中多余的氨。
①原理:2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O ②药品:氯化铵晶体、熟石灰固体 ③装置:固+固,加热型(与O2的发生装置相同) ④干燥:用碱石灰(CaO 与NaOH固体混合物) 思考:干燥时,能否用浓硫酸、无水CaCl2或者P2O5来代替碱石灰? ⑤收集:向下排空气法,并在试管口塞上棉花,防止NH3和空气对流,保证NH3的纯度。 ⑥验满:(1)用湿润的红色石蕊试纸(变蓝) (2)蘸有浓盐酸(浓硝酸)的玻璃棒接近试管口(产生白烟)。 实验室中还可以用哪些方法制氨气?
NH3·H2O NH3↑+H2O ②浓氨水加碱石灰法(气体的溶解性规律?)碱石灰吸水、溶解时放热,增大OH-浓度。
平衡逆移.NH4++OH- NH3↑+H2O ⑦尾气吸收:氨气不能直接排放到空气中,可以用将多余的氨气通入水中进行吸收(要注意放倒吸)。 ⑧易溶于水的要用防倒吸装置
〖注意〗 ① 制氨气所用的铵盐不能用NH4NO3、NH4HCO3、 (NH4)2CO3等代替,NH4NO3加热时爆炸,而NH4HCO3、(NH4)2CO3极易分解产生CO2气体使制得的NH3不纯。 ② 消石灰不能用NaOH、KOH等强碱代替,因为NaOH、KOH具有吸湿性,易潮解结块,不利于生成的氨气逸出,而且NaOH、KOH对玻璃有强烈的腐蚀作用。 ③ NH3极易溶于水,制取和收集的容器必须干燥。 课堂梳理:氨-------(NH3)
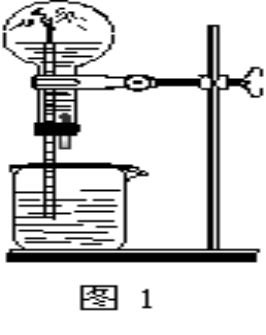
2.如何引发喷泉? 3.氨的化学性质 4.氨实验室制法 5.铵盐的有关反应 6.氨气的实验室制法 课堂练习: 1.如图1为喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是( ) A、HCl和H2O B、O2和H2O C、NH3和H2O D、CO2和NaOH
答案为:B 解析:形成喷泉,使烧瓶内外形成较大的压差,要么是气体溶解度比较大、要么是气体可以和烧杯中溶液发生反应。氧气在水中溶液度较小,不能形成喷泉。 2.下列装置能达到实验目的的是( )
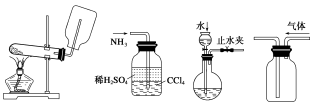
①制取并收集NH3;②吸收NH3; ③检查气密性;④排空气法收集CO2。 A.①③ B.②③ C.①④ D.②④ 答案为:B 解析:①氨气密度比空气小,可以采用向下排空气法,但是试管口需要放置棉花;②分液法可以用来吸收氨气;③可以利用压强差检测气密性;④氯气密度比空气大,可以采用向上排空气法,要长进短出。 3.下列不属于铵盐的共同性质是( ) A、加热时一定有氨气生成 B、与碱共热时都产生氨气 C、都是晶体 D、易溶于水 答案为:A 解析:NH4NO3在400 ℃以上分解生成N2、NO2和H2O 4.只用一种试剂,就可区别NH4Cl 、 (NH4)2SO4 、 KCl Na2SO4 、 AlCl3 五种 无色溶液,这种试剂是( ) (A)NaOH溶液 (B)AgNO3溶液 (C)BaCl2溶液 (D)Ba(OH)2溶液 答案为:D A.NaOH溶液溶液和NH4Cl 、(NH4)2SO4 反应都产生氨气,无法鉴别;和KCl Na2SO4 、不反应,无法鉴别; B.AgNO3溶液和NH4Cl 、(NH4)2SO4 、 KCl、 Na2SO4 、 AlCl3均有白色沉淀,无法鉴别; C.BaCl2溶液和(NH4)2SO4、Na2SO4反应都生成白色沉淀;和NH4Cl、KCl、AlCl3 不反应,不可鉴别; D.Ba(OH)2溶液和NH4Cl有氨气产生;和(NH4)2SO4有气体和沉淀;和KCl无现象;和Na2SO4有沉淀、和AlCl3四先产生沉淀,沉淀再溶液,现象不同,可以鉴别; 5、下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
答案为:C 【解析】实验室制备NH3的方法不只一种,除课本介绍的由NH4Cl与碱石灰反应制取之外,其他的只要合理亦可。①装置中NH4Cl加热分解产生的NH3、HCl很容易在管口重新化合成NH4Cl,而无法收集到NH3。③装置在加热时,管口应略向下倾斜,以防止冷凝水倒流使试管底部破裂。
|
|
|
课堂小结 | 课堂小结: 一:氨的结构和性质 二:铵盐的性质 三:氨气的实验室制法 四:氨气的工业制法 |
|
|
板书 | 一、氨的结构和性质 二、铵盐的性质 三、氨气的实验室制法 |
|
|
高中化学人教版 (2019)必修 第二册第二节 氮及其化合物图文ppt课件: 这是一份高中化学人教版 (2019)必修 第二册<a href="/hx/tb_c4000034_t3/?tag_id=26" target="_blank">第二节 氮及其化合物图文ppt课件</a>,共1页。
高中化学人教版 (2019)必修 第二册第二节 氮及其化合物优质课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第二节 氮及其化合物优质课件ppt,文件包含新人教版必修2化学52《氮及其化合物》第三课时课件pptx、氮及其化合物教学设计第三课时doc等2份课件配套教学资源,其中PPT共33页, 欢迎下载使用。
高中化学人教版 (2019)必修 第二册第二节 氮及其化合物公开课ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第二节 氮及其化合物公开课ppt课件,文件包含新人教版必修2化学52《氮及其化合物》第一课时课件pptx、52氮及其化合物教学设计第一课时doc等2份课件配套教学资源,其中PPT共32页, 欢迎下载使用。