

高中化学人教版 (2019)必修 第二册第二节 氮及其化合物优秀第一课时导学案
展开第一课时 氮的氧化物
[明确学习目标] 1.了解氮气的性质及固氮方法。2.认识一氧化氮、二氧化氮的性质,熟知氮的氧化物溶于水反应的化学方程式。
学生自主学习
氮气与氮的固定
1.氮气无色、无味、不溶于水,约占空气体积的eq \f(4,5)。通常情况下,化学性质很稳定,与其他物质难以反应。在放电或高温下,与氧气反应的化学方程式为eq \(□,\s\up3(01))N2+O2eq \(=====,\s\up15(放电或高温))2NO。
N2与镁、氢气反应的方程式分别是:eq \(□,\s\up3(02))N2+3Mgeq \(=====,\s\up15(点燃))Mg3N2;eq \(□,\s\up3(03))N2+3H2eq \(,\s\up15(高温、高压),\s\d15(催化剂))2NH3。
2.氮的固定
(1)定义:使eq \(□,\s\up3(04))游离态的氮转化为eq \(□,\s\up3(05))氮的化合物的过程。
(2)类别
一氧化氮与二氧化氮
1.一氧化氮是eq \(□,\s\up3(01))无色、无味、不溶于水的有毒气体,与氧气反应的化学方程式为eq \(□,\s\up3(02))2NO+O2===2NO2。
2.二氧化氮是eq \(□,\s\up3(03))红棕色、有eq \(□,\s\up3(04))刺激性气味的有毒气体,易液化,eq \(□,\s\up3(05))易溶于水,与水反应的化学方程式为eq \(□,\s\up3(06))3NO2+H2O===2HNO3+NO,工业上利用这一原理生产eq \(□,\s\up3(07))硝酸。
[特别提醒] (1)实验室里收集NO气体是用排水集气法而不能用排空气法。
(2)检验NO气体的方法是向气体中通入O2(或空气),气体由无色变为红棕色。
1.实验室能否用排空气法收集NO气体?能否用排水法收集NO2?为什么?
提示:不能。NO与空气的密度十分接近且易与空气中的O2反应,故不能用排空气法收集,一般用排水法收集;NO2易与H2O发生反应,故不能用排水法收集,一般用向上排空气法收集。
2.如何除去NO气体中混有的少量NO2气体杂质?
提示:根据NO2与H2O反应能生成NO,既能除去NO2杂质,又不引入其他杂质,故可将混合气体通入盛有水的洗气瓶,然后重新收集气体。
课堂互动探究
氮的氧化物与水反应的实验探究
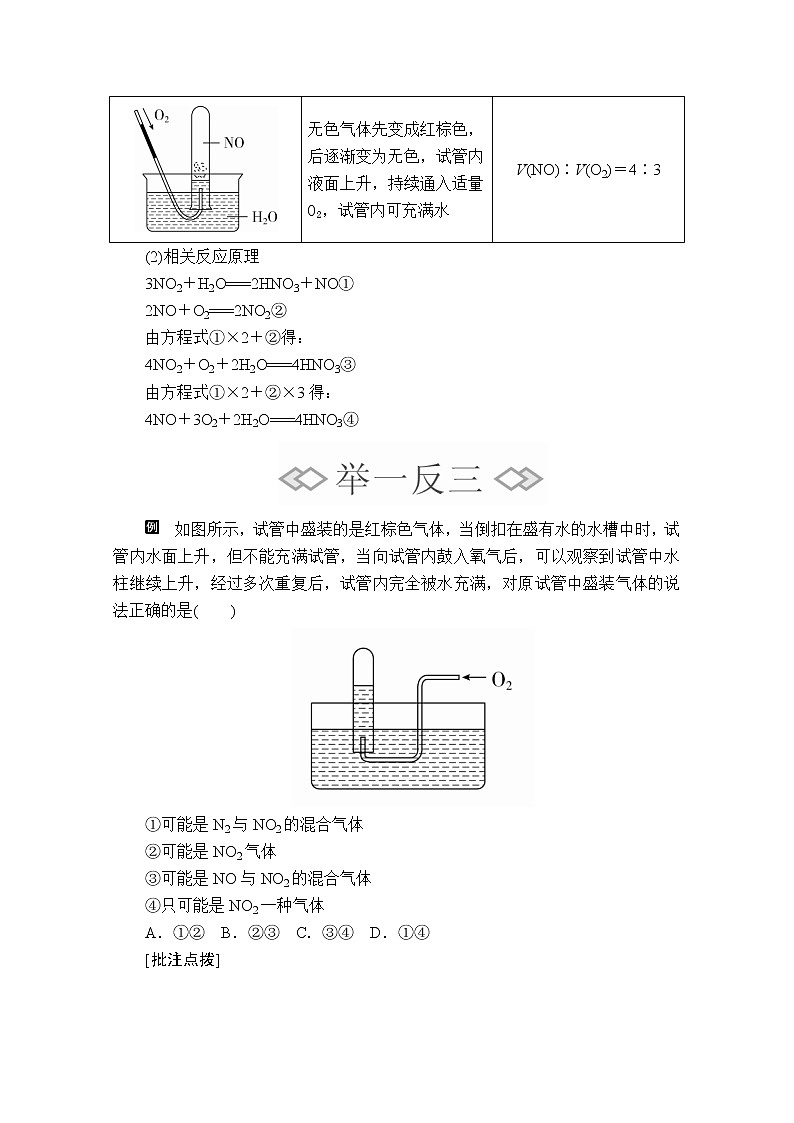
(1)操作方法
将充满NO2、NO的试管分别倒置于水槽中,并通过导管通入少量的氧气。
(2)相关反应原理
3NO2+H2O===2HNO3+NO①
2NO+O2===2NO2②
由方程式①×2+②得:
4NO2+O2+2H2O===4HNO3③
由方程式①×2+②×3得:
4NO+3O2+2H2O===4HNO3④
如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,对原试管中盛装气体的说法正确的是( )
①可能是N2与NO2的混合气体
②可能是NO2气体
③可能是NO与NO2的混合气体
④只可能是NO2一种气体
A.①② B.②③ C.③④ D.①④
[批注点拨]
[解析] 是红棕色气体,那么一定有二氧化氮的存在,与水反应后生成一氧化氮,所以没有充满试管,继续通入氧气,最终充满试管,则①肯定错误;③中通入足量的氧气,NO也可以全部被吸收。
[答案] B
[练1] 在一定温度和压强下,将一容积为15 mL的试管充满NO2后,倒置于一个盛有水的水槽中。当试管内液面上升至一定高度不再变化时,在相同条件下再通入O2,若要使试管内液面仍保持在原高度,则通入O2的体积为( )
A.3.75 mL B.7.5 mL
C.8.75 mL D.10.5 mL
答案 C
解析 15 mL NO2与水反应后生成5 mL NO,根据反应4NO+3O2+2H2O===4HNO3,使5 mL NO完全被氧化需O2体积为5 mL×eq \f(3,4)=3.75 mL。据题意,通入的O2应过量5 mL,则共需通入O2 8.75 mL。
[练2] 将10 mL充满NO2和O2的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2 mL的无色气体,求原混合气体中NO2和O2各多少毫升?
答案 剩余2 mL气体可能是NO或O2,分两种情况讨论:(1)剩余的是NO,可以看成先发生了反应:4NO2+O2+2H2O===4HNO3,剩余的NO2又与水作用,最终有2 mL NO产生。由反应3NO2+H2O===2HNO3+NO得剩余的NO2体积为2 mL×3=6 mL。则原有O2体积为(10 mL-6 mL)×eq \f(1,4+1)=0.8 mL,NO2体积为10 mL-0.8 mL=9.2 mL。
(2)剩余的是O2,则有10 mL-2 mL=8 mL是NO2和O2的混合气体,按反应:4NO2+O2+2H2O===4HNO3进行计算。所以NO2的体积为8 mL×eq \f(4,1+4)=6.4 mL,O2体积为10 mL-6.4 mL=3.6 mL。
eq \a\vs4\al([知识拓展]) 氮的氧化物与水反应的计算规律
(1)NO2单独溶于水(按反应3NO2+H2O===2HNO3+NO计算)
剩余气体是NO,V(NO)=eq \f(1,3)V(NO2)。
(2)NO2与O2的混合气体溶于水(按反应4NO2+O2+2H2O===4HNO3计算)
eq \f(VNO2,VO2)eq \b\lc\{\rc\ (\a\vs4\al\c1(\a\vs4\al(<4∶1 O2过量,剩余O2,, V=VO2-\f(1,4)VNO2,=4∶1 恰好完全反应,无剩余气体,>4∶1 NO2过量,剩余NO,V=, \f(1,3)[VNO2-4VO2])))
(3)NO与O2的混合气体溶于水(按反应4NO+3O2+2H2O===4HNO3计算)
eq \f(VNO,VO2)eq \b\lc\{\rc\ (\a\vs4\al\c1(<\f(4,3) O2过量,剩余O2,, V=VO2-\f(3,4)VNO,=\f(4,3) 恰好完全反应,无剩余气体,>\f(4,3) NO过量,剩余NO,, V=VNO-\f(4,3)VO2))
本课归纳总结
1.一氧化氮是无色、无味、不溶于水的有毒气体,易与空气中的氧气反应生成二氧化氮,即2NO+O2===2NO2。
2.二氧化氮是红棕色有刺激性气味的有毒气体,易
溶于水生成HNO3和NO,化学方程式为3NO2+H2O===2HNO3+NO。
3.氮的氧化物溶于水的总反应为4NO+3O2+2H2O===4HNO3,4NO2+O2+2H2O===4HNO3。
学习效果检测
1.湿润的淀粉碘化钾试纸接触某气体而显蓝色,该气体可能是下列气体中的( )
①Cl2 ②NO2 ③H2S ④SO2 ⑤溴蒸气 ⑥HCl
A.①③④ B.①②⑤ C.①②⑥ D.②④⑥
答案 B
解析 显蓝色表明接触过程中发生氧化还原反应生成了单质I2。其反应如下:①Cl2+2KI===I2+2KCl,②3NO2+H2O===2HNO3+NO,HNO3将KI氧化成I2,⑤Br2+2KI===I2+2KBr。
2.将盛有30 mL NO和NO2混合气体的试管倒置于放满水的水槽中,最后试管中气体的体积是20 mL,则原混合气体中NO的体积是( )
A.24 mL B.15 mL C.18 mL D.12 mL
答案 B
解析 NO2与水反应3NO2+H2O===2HNO3+NO,设原混合气体中NO与NO2的体积分别为x、y,则据题意,剩余气体体积20 mL是原NO气体与上述反应生成的NO气体的总体积,列方程即可得NO和NO2体积都是15 mL。
3.在NO2被水吸收的反应中,发生还原反应的物质和发生氧化反应的物质的物质的量之比为( )
A.3∶1 B.1∶3 C.1∶2 D.2∶1
答案 C
解析 3NO2+H2O===2HNO3+NO,3 ml NO2中,有2 ml氮原子的价态升高,1 ml氮原子的价态降低,所以发生还原反应的NO2与发生氧化反应的NO2的物质的量之比为1∶2。
4.下列物质的转化必须加入氧化剂且通过一步反应就能完成的是( )
①N2→NO2 ②NO2→NO ③NO2→HNO3
④N2→NO ⑤N2→NH3
A.① B.②⑤ C.④ D.③④
答案 C
解析 该题有两个要求:(1)必须加入氧化剂;(2)通过一步反应就能完成。反应①、③、④从化合价角度来看都是升高,但反应①N2→NO2不能通过一步反应完成;而反应③NO2→HNO3虽然氮的化合价升高,但不加氧化剂也能完成,如3NO2+H2O===2HNO3+NO,在该反应中,NO2既是氧化剂又是还原剂;只有反应④N2→NO必须加入氧化剂且通过一步反应就能完成。
5.一氧化氮是大气污染物之一。目前,有一种治理方法是在400 ℃左右、有催化剂存在的情况下,用氨把一氧化氮还原为氮气和水。请写出该反应的化学方程式:__________________________________。
答案 6NO+4NH3eq \(=====,\s\up15(催化剂),\s\d15(400 ℃))5N2+6H2O
6.利用如图所示装置收集以下7种气体(图中烧瓶的位置不得变化)。
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦SO2
(1)若烧瓶是干燥的,则由B口进气收集的气体有________(写序号)。
(2)若烧瓶充满水,可收集的气体有________,这时气体由________口进入。
(3)若烧瓶是干燥的,则由A口进气,可收集的气体有________。
(4)若在烧瓶内装入浓硫酸使气体干燥,则可用此装置来干燥的气体有________,这时气体由________口进入。
答案 (1)②④⑦ (2)①③⑥ A (3)①③⑤
(4)①②③④⑥⑦ B
实验装置
实验现象
试管充满水需满足的条件
红棕色气体逐渐变为无色,试管内液面上升,持续通入适量O2,试管内可充满水
V(NO2)∶V(O2)=4∶1
无色气体先变成红棕色,后逐渐变为无色,试管内液面上升,持续通入适量O2,试管内可充满水
V(NO)∶V(O2)=4∶3
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物优秀第二课时导学案: 这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物优秀第二课时导学案,共12页。
人教版 (2019)必修 第二册化工生产中的重要非金属元素单元综合与测试精品学案: 这是一份人教版 (2019)必修 第二册化工生产中的重要非金属元素单元综合与测试精品学案,共3页。
人教版 (2019)必修 第二册第二节 氮及其化合物精品第三课时导学案: 这是一份人教版 (2019)必修 第二册第二节 氮及其化合物精品第三课时导学案,共11页。













