







人教版 (2019)第三节 金属的腐蚀与防护多媒体教学ppt课件
展开人教版化学选修一
《金属的腐蚀》教学设计
课题名 | 金属的腐蚀 |
教学目标 | 1.通过分析原电池原理,了解金属发生电化学腐蚀的本质,能解释金属腐蚀现象,发展宏观辨识与微观探析的学科核心素养。 2.通过分析电解池原理,了解防止金属腐蚀的措施,能选择并设计金属防护的措施。 3.通过查阅资料,知道金属腐蚀的严重性及危害,了解化学在生产中的重要作用,发展科学态度与社会责任的学科核心素养。 |
教学重点 | 金属发生电化学腐蚀的本质 |
教学难点 | 析氢腐蚀和吸氧腐蚀 |
教学准备 | 教师准备:课件、例题 学生准备:复习知识电化学 |
教学过程 | 一.新课导入 图片展示 铁锈主要成分:Fe2O3 • xH2O 铜绿主要成分:Cu2(OH)2 CO3 我国是世界上钢铁产量最多的国家,但每年被腐蚀的铁占到我国钢铁年产量的十分之一,因为金属腐蚀而造成的损失占到国内生产总值2%~4%;约合人民币:6000亿元(2008年我国国内生产总值为30万亿元)
二.知识精讲 (一)金属的腐蚀 1.概念 金属或合金与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。 2.金属腐蚀的本质 金属原子失去电子变为阳离子,金属发生氧化反应。
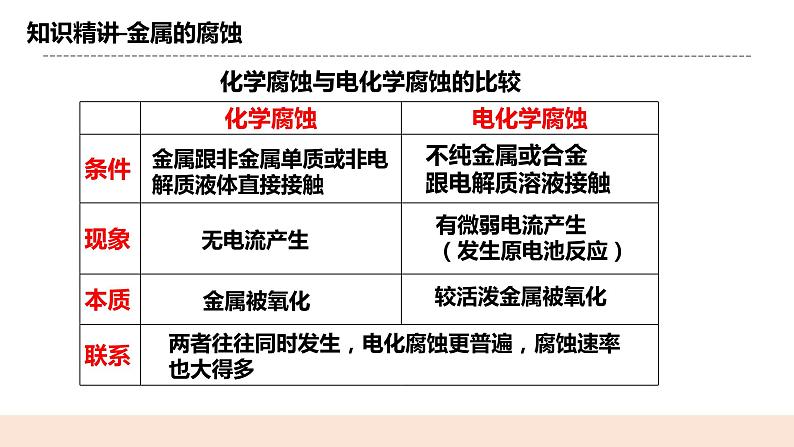
3.金属的腐蚀的类型——根据与金属接触的气体或液体不同 化学腐蚀:金属与其表面接触的一些物质(如O2、Cl2、SO2等)直接反应而引起的腐蚀。腐蚀的速率随温度升高而 加快。 电化学腐蚀:不纯的金属与电解质溶液接触时,会发生原电池反应,比较活泼的金属发生氧化反应而被腐蚀
化学腐蚀与电化学腐蚀的比较
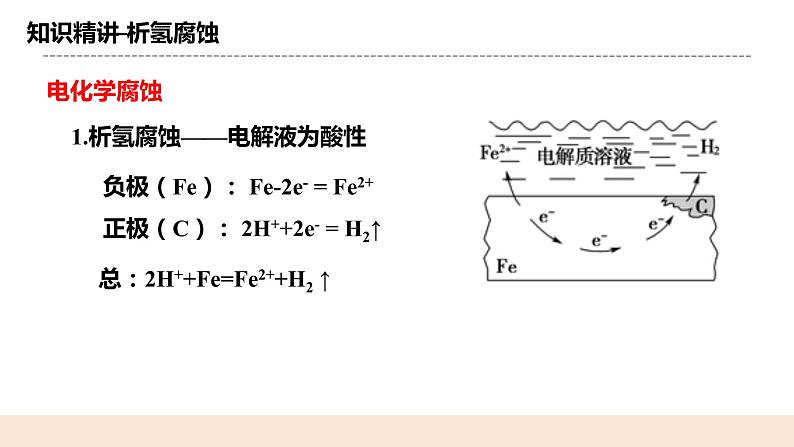
(二)析氢腐蚀 析氢腐蚀——电解液为酸性 负极(Fe): Fe-2e- = Fe2+ 正极(C): 2H++2e- = H2↑ 总:2H++Fe=Fe2++H2 ↑
(二)吸氧腐蚀 【实验】将用酸洗除锈的铁钉,在饱和食盐水浸泡后放在如图所示的装置中,几分钟后观察导管中水柱的变化。 实验现象:几分钟后,装置中的导管中水柱上升, 结论:说明装置中有气体参加反应。 1.吸氧腐蚀——电解液为中性或碱性 负极:Fe - 2e- = Fe2+ 正极:O2 + 2H2O + 4e-= 4OH- 总反应:2Fe+2H2O+O2=2Fe(OH)2 2.析氢腐蚀和吸氧腐蚀 3.金属腐蚀快慢的判断 1.在同一电解质溶液中: 电解原理腐蚀>原电池原理腐蚀>化学腐蚀>有防腐措施的腐蚀 2.同一种金属的腐蚀: 强电解质>弱电解质>非电解质
三.课堂小结
四.随堂练习 1.判断正误,正确的画“√”,错误的画“×”。 (1)金属的腐蚀全都是氧化还原反应。 ( ) (2)金属的腐蚀分为化学腐蚀和电化学腐蚀。( ) (3)因为CO2普遍存在,所以钢铁的腐蚀以析氢腐蚀为主。( ) (4)钢铁发生析氢腐蚀时负极反应为Fe-2e-====Fe2+, 发生吸氧腐蚀时负极反应为Fe-3e-====Fe3+。( ) (5)牺牲阳极的阴极保护法是利用的电解池原理。( ) (6)普通钢制镍铬钢是改变金属的内部结构。( )
|
布置作业 | 化学课时作业《金属的腐蚀》 |
板书设计 | |
教学反思 | 本节的知识本质上都是电话学的知识,学生已有相关的知识经验。在教学过程中,教师可结合生活实际,多引导学生运用所学知识解释原理。 |
人教版 (2019)选择性必修1第三节 金属的腐蚀与防护背景图ppt课件: 这是一份人教版 (2019)选择性必修1第三节 金属的腐蚀与防护背景图ppt课件,共22页。PPT课件主要包含了《青花瓷》方文山,金属腐蚀,氧化还原,阳离子,无电流产生,有微弱电流产生,金属被氧化,较活泼的金属被氧化,潮湿空气,电解质溶液H+等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第三节 金属的腐蚀与防护完美版课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第三节 金属的腐蚀与防护完美版课件ppt,文件包含431金属的腐蚀练习解析版docx、431金属的腐蚀练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
高中人教版 (2019)第三节 金属的腐蚀与防护精品ppt课件: 这是一份高中人教版 (2019)第三节 金属的腐蚀与防护精品ppt课件,文件包含人教版高中化学选择性必修一431金属的腐蚀课件pptx、人教版高中化学选择性必修一431金属的腐蚀学案docx等2份课件配套教学资源,其中PPT共32页, 欢迎下载使用。














