
高中化学人教版 (2019)选择性必修1第三节 金属的腐蚀与防护教学设计
展开1.学习目标
(1)根据金属腐蚀的本质,掌握不同金属防腐措施的原理。
(2)利用电化学原理选择并设计防腐措施,进一步增强社会责任感。
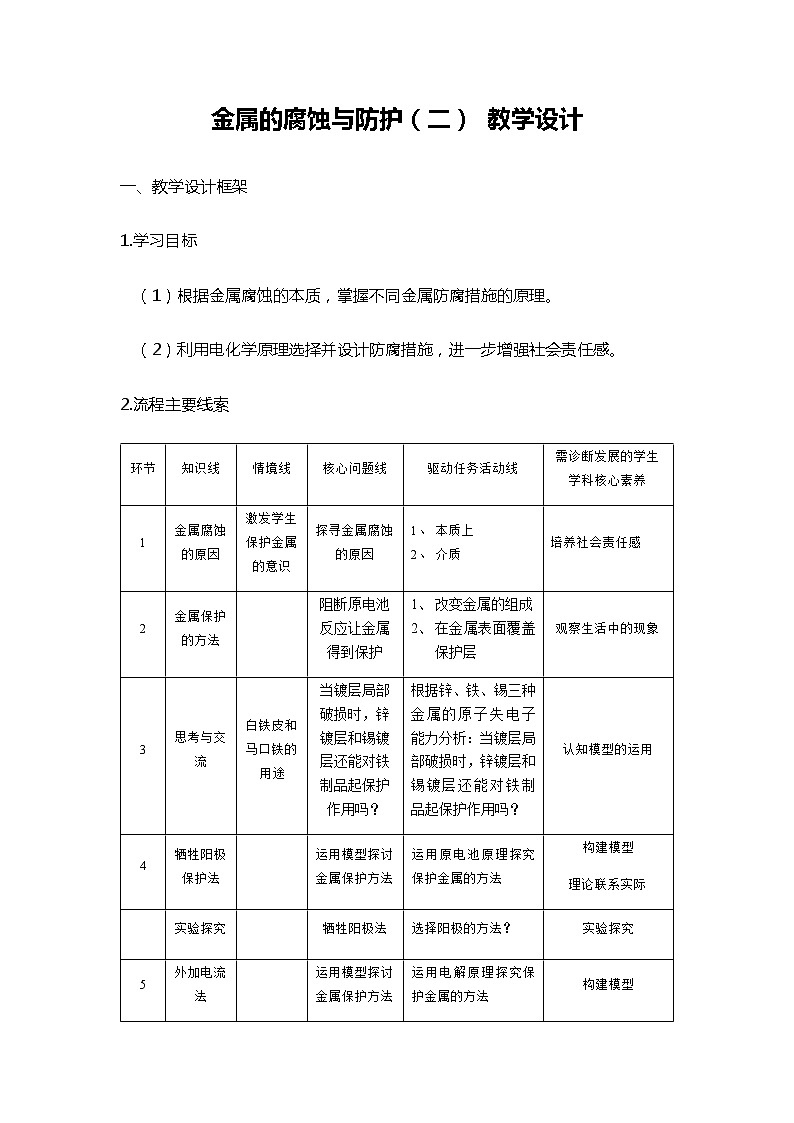
2.流程主要线索
3.练习反馈
第一题:在下图所示装置的烧杯中均盛有海水,其中能保护铁不被腐蚀的是()
第二题:海港、码头的钢制管桩会受到海水的长期侵袭,常用外加电流法对其进行保护(如下图所示,其中高硅铸铁为惰性辅助阳极),下列有关叙述中错误的是( )
A.高硅铸铁是作为损耗阳极材料发挥作用的
B.通电后外电路的电子被强制流向钢制管桩
C.保护电流应该根据环境条件变化进行调整
D.通电后使钢制管桩表面的腐蚀电流接近零
第三题:【2020江苏卷】将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是
A.阴极的电极反应式为 Fe-2e- = Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
4.小结即板书设计
5.作业
基础题:课本第113页 5、6题
综合题:课本第113页 7题
6.结语(励志预)
人必须要有耐心,特别是要有信心。——居里夫人
二、教学设计:
环节
知识线
情境线
核心问题线
驱动任务活动线
需诊断发展的学生学科核心素养
1
金属腐蚀的原因
激发学生保护金属的意识
探寻金属腐蚀的原因
本质上
介质
培养社会责任感
2
金属保护的方法
阻断原电池反应让金属得到保护
改变金属的组成
在金属表面覆盖保护层
观察生活中的现象
3
思考与交流
白铁皮和马口铁的用途
当镀层局部破损时,锌镀层和锡镀层还能对铁制品起保护作用吗?
根据锌、铁、锡三种金属的原子失电子能力分析:当镀层局部破损时,锌镀层和锡镀层还能对铁制品起保护作用吗?
认知模型的运用
4
牺牲阳极保护法
运用模型探讨金属保护方法
运用原电池原理探究保护金属的方法
构建模型
理论联系实际
实验探究
牺牲阳极法
选择阳极的方法?
实验探究
5
外加电流法
运用模型探讨金属保护方法
运用电解原理探究保护金属的方法
构建模型
理论联系实际
6
总结
教学环节
教学活动
分析金属腐蚀的原因
提出问题:金属腐蚀的原因?
本性上看: 金属越活泼,就越容易失去电子而被腐蚀,如果金属中能导电的杂质不如该金属活泼,则容易形成原电池而使金属发生电化学腐蚀。
从介质上看:金属在潮湿的空气中、接触腐蚀性气体或电解质溶液,都容易被腐蚀。
金属防护
的方法
【提出问题】
阻断原电池反应就可以让金属得到保护,怎样阻断呢?
1.金属防护的第一种方法是改变金属的内部组织结构
2. 在金属表面覆盖保护层 如:涂油漆、镀Zn、镀Sn、镀Cr等,或制成氧化膜。
【思考与讨论】
白铁皮和马口铁的表面出现破损,两者的腐蚀情况怎样呢?
【运用模型】
电化学体系模型的应用—建构牺牲阳极法模型
【实验探究】
通过演示实验验证牺牲阳极的阴极保护法
3. 在要保护的金属上连接一种比该金属更易失去电子的金属。 ----称为“牺牲阳极法”
4.钢铁设备被迫成为阴极而受到保护——称为“外加电流法。”
小结
人教版 (2019)选择性必修1第三节 金属的腐蚀与防护教案: 这是一份人教版 (2019)选择性必修1第三节 金属的腐蚀与防护教案,共3页。教案主要包含了导入新课,新课讲授等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡教案: 这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡教案,共10页。
2021学年第三节 金属的腐蚀与防护教案: 这是一份2021学年第三节 金属的腐蚀与防护教案,共5页。教案主要包含了教学设计框架,教学设计等内容,欢迎下载使用。













