





高中化学人教版 (2019)选择性必修1第三节 金属的腐蚀与防护优秀课件ppt
展开生活情境 金属的腐蚀在生活中非常普遍
【任务1】阅读课本P107,回答下列问题
1.什么是金属腐蚀?有哪些类别?2.化学腐蚀和哪些因素有关?3.什么是电化学腐蚀?原理是什么?
金属腐蚀是指金属或合金跟周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。
宏观辨识 实验探究
【任务2】实验探究1. 用盐酸清洗铁钉除锈;2.把1枚铁钉放入一个具支试管,并加入约5ml稀盐酸;3.把1枚铁钉用食盐水清洗,放入具支试管,加入5ml 食盐水;4.按照右图接好装置;5.观察试管中水柱的变化,思考引起变化的原因。
铁钉表面和导气管均有气泡产生,
微观探析 符号表征 模型建构
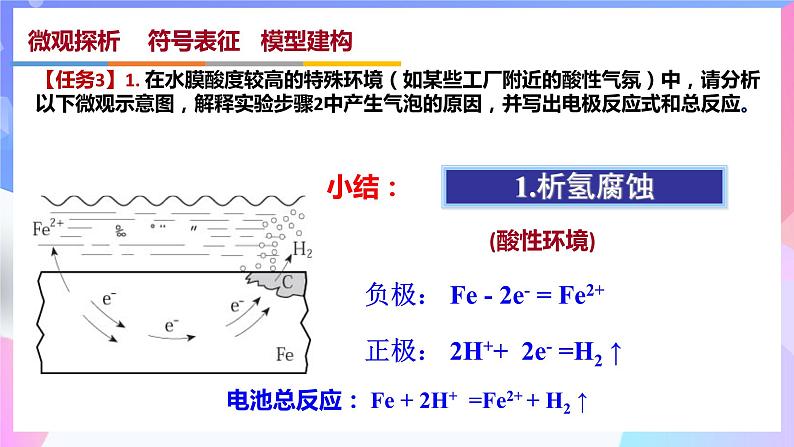
【任务3】1. 在水膜酸度较高的特殊环境(如某些工厂附近的酸性气氛)中,请分析以下微观示意图,解释实验步骤2中产生气泡的原因,并写出电极反应式和总反应。
正极: 2H++ 2e- =H2 ↑
负极: Fe - 2e- = Fe2+
电池总反应: Fe + 2H+ =Fe2+ + H2 ↑
【任务3】2.请分析以下微观示意图,解释实验步骤3中导管液面上升的原因,并写出电极反应式和总反应。
负极(铁):2Fe-4e-=2Fe2+ 正极(碳):2H2O + O2+4e-=4OH-
4Fe(OH)2 +O2 + 2H2O =4 Fe(OH)3 Fe(OH)3脱水 Fe2O3·xH2O
电化学模型运用 金属的电化学防护
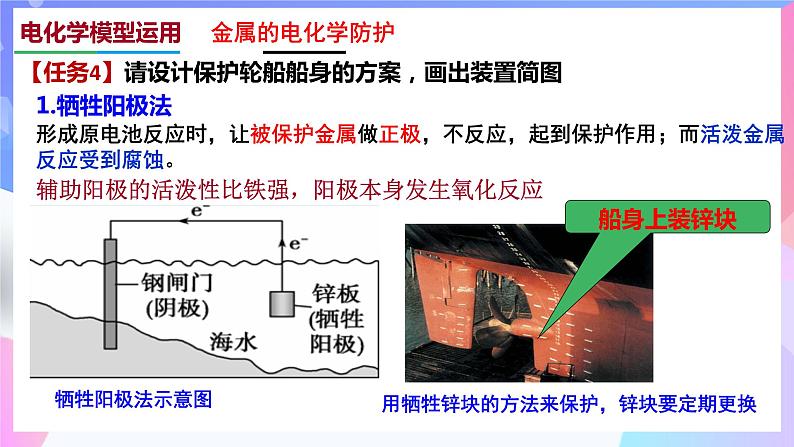
形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。
用牺牲锌块的方法来保护,锌块要定期更换
【任务4】请设计保护轮船船身的方案,画出装置简图
辅助阳极的活泼性比铁强,阳极本身发生氧化反应
如何防止地下钢铁管道的腐蚀?
用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块要定期更换
书P110 牺牲阳极法的实验探究Fe2+的检验方法:Fe2+与黄色K3[Fe(CN)6] (铁氰化钾)溶液反应生成特征蓝色沉淀。
2H++ 2e- = H2↑
Zn -2e- = Zn2+
电化学模型运用 金属的电化学防护
(2014广东卷)石墨可用于自然水体中铜件的电化学防腐,完成图19防腐示意图,并作相应标注。
2.外加电流法 把被保护金属作为阴极,用惰性电极作为辅助阳极,两者均存在电解质溶液里,在外加直流电的作用下,电子被强制流向阴极(阴极金属表面腐蚀电流降为零或接近与零),使阴极得到保护。此法主要用于防止土壤、海水及水中金属设备的腐蚀。
辅助阳极为惰性电极,阴离子在其表面失电子发生氧化反应
除此以外还有其它防护方法?
改变金属材料的组成 在金属中添加其他金属或非金属制成性能优异的合金。
钛合金不仅具有优异的抗腐蚀性,还具有良好的生物相容性。
如把铬、镍等加入普通钢中制成不锈钢产品。
在金属表面覆盖保护层 金属腐蚀通常发生在金属表面,因此给金属表面加上致密的保护层将金属与外界环境隔离开,可以起到防止金属腐蚀的作用。
(1)在钢铁制品的表面喷涂油漆、矿物性油脂或覆盖搪瓷、塑料等。(2)用电镀等方法在钢铁表面镀上一层锌、锡、铬、镍等金属。(3)用化学方法在钢铁部件表面进行发蓝处理(生成一层致密的四氧化三铁薄膜)。(4)利用阳极氧化处理铝制品的表面,使之形成致密的氧化膜而钝化。另外采用离子注入、表面渗镀等方式在金属表面形成稳定的钝化膜。
某些工具的“机械传动部位” ,能用油漆来防锈吗?
不能用油漆来防锈,而是选用油脂
自行车的钢圈和车铃是在钢上镀上一层耐腐蚀又耐磨的Cr
自行车的车把、车辐条、钢圈和车铃防锈措施是什么?
思考与讨论:常用的白铁皮是在薄钢板表面镀上一层锌,罐装食品用的马口铁是在薄钢板表面镀上一层锡。 若上述两种钢铁制品的表面出现破损时,请分析并说明白铁皮、马口铁的腐蚀情况。
镀锌铁板更耐腐蚀。当镀锌铁板出现划痕时,暴露出来的铁将与锌形成原电池的两个电极,且锌为负极,铁为正极,故铁板上的镀锌层将先被腐蚀,镀锌层腐蚀完后才腐蚀铁板本身。镀锡铁板如有划痕,锡将成为原电池的正极,铁为负极,这样就会加速铁的腐蚀。
制作屋面、卷管和各种容器
钢铁“发蓝”是在钢铁表面形成一层致密的Fe3O4薄膜的技术.其中一种方法是将钢铁制品浸到NaNO2和浓NaOH的混合溶液中加热到130℃.其过程可以用如下化学方程式表示: ①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑ ②6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH ③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH 则反应②中的氧化剂是 (填化学式)
该生产过程有什么缺点?
阳极:2Al- 6e- +3H2O = Al2O3+6H+
阴极:6H++6e- = 3H2↑
【学习评价】(2017. 全国Ⅱ卷)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。下列叙述错误的是( ) A.待加工铝质工件为阳极B.可选用不锈钢网作为阴极C.阴极的电极反应式为:Al3+ + 3e- = AlD.硫酸根离子在电解过程中向阳极移动
a、改变金属材料的组成:如将金属制成合金,如不锈钢b、在金属表面覆盖保护层:如涂油漆、油脂、电镀或表 面钝化等。c、牺牲阳极法:在要保护的金属上连接一种 比该种金属更易失去电子的金属(形成原电池保护)d、外加电流法:把被保护的金属做电解池的 阴极,用惰性电极做辅助阳极
【学习评价】下列各情况,在其中Fe片腐蚀由慢到快的顺序是
(4)< (3) <(1) <(2) <(5)
判断:金属被保护的比较规律
【学习评价】(2017全国Ⅰ卷11)支撑海港码头基础的钢管桩, 常用外加电流的阴极保护法进行防腐, 工作原理如图所示, 其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是A .通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整
保护电流应根据环境(pH值,离子浓度,温度)变化
高中化学鲁科版 (2019)选择性必修1第1章 化学反应与能量转化第4节 金属的腐蚀与防护教学ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002576_t3/?tag_id=26" target="_blank">第1章 化学反应与能量转化第4节 金属的腐蚀与防护教学ppt课件</a>,共26页。PPT课件主要包含了金属的腐蚀,M-ne-→Mn+,1化学腐蚀,2电化学腐蚀,正极反应物,总反应,FeOH3,金属的防护,在金属表面覆盖保护层,白铁皮镀锌铁等内容,欢迎下载使用。
高中化学第三节 金属的腐蚀与防护图文ppt课件: 这是一份高中化学第三节 金属的腐蚀与防护图文ppt课件,共27页。PPT课件主要包含了铁制品生锈,铜制品产生铜绿,金属的腐蚀,M-ne-→Mn+,氧化反应,3分类,钢铁的电化学腐蚀,析氢腐蚀,吸氧腐蚀,实验探究等内容,欢迎下载使用。
化学第四章 化学反应与电能第三节 金属的腐蚀与防护试讲课课件ppt: 这是一份化学第四章 化学反应与电能第三节 金属的腐蚀与防护试讲课课件ppt,文件包含新人教版化学选择性必修一43金属的腐蚀与防护课件pptx、新人教版化学选择性必修一43金属的腐蚀与防护针对练习含解析docx、新人教版化学选择性必修一43金属的腐蚀与防护教案doc等3份课件配套教学资源,其中PPT共25页, 欢迎下载使用。













