

化学选择性必修1第三单元 盐类的水解第2课时导学案
展开第2课时 盐类水解的影响因素及应用
一、内因对盐类水解平衡的影响
1.实验探究内因对水解平衡的影响
已知常温下HClO、CH3COOH、HNO2的电离平衡常数Ka分别为 4.0×10-8、1.8×10-5、5.6×
10-4。
用pH计测量下列三种盐溶液的pH如下表:
盐溶液/ (0.1 mol·L-1)
pH
解释与结论
NaClO
10.3
HClO的Ka最小,水解程度最大
CH3COONa
9.0
CH3COOH的Ka较大,水解程度较小
NaNO2
8.2
HNO2的Ka最大,水解程度最小
实验结论:在盐水解过程中,若生成的弱电解质越难电离,则生成弱电解质的倾向越大,盐水解程度就越大,溶液中c(H+)和c(OH-)的差别越大。
2.规律总结
盐自身的组成和性质是决定盐类水解程度的主要因素。
(1)盐的离子对应的酸或碱越弱,则水解程度越大,即越弱越水解。
(2)正盐离子比其对应酸式盐离子的水解程度大。
如,物质的量浓度相同时,pH: Na2CO3 > NaHCO3。
根据下列几种弱酸或弱碱的相对强弱,分析同浓度时下列盐溶液酸碱性的强弱。
①不同弱酸对应的盐
弱酸的酸性强弱:HClO
②不同弱碱对应的盐
弱碱的碱性强弱:Mg(OH)2>Fe(OH)3
酸性:MgCl2(aq)
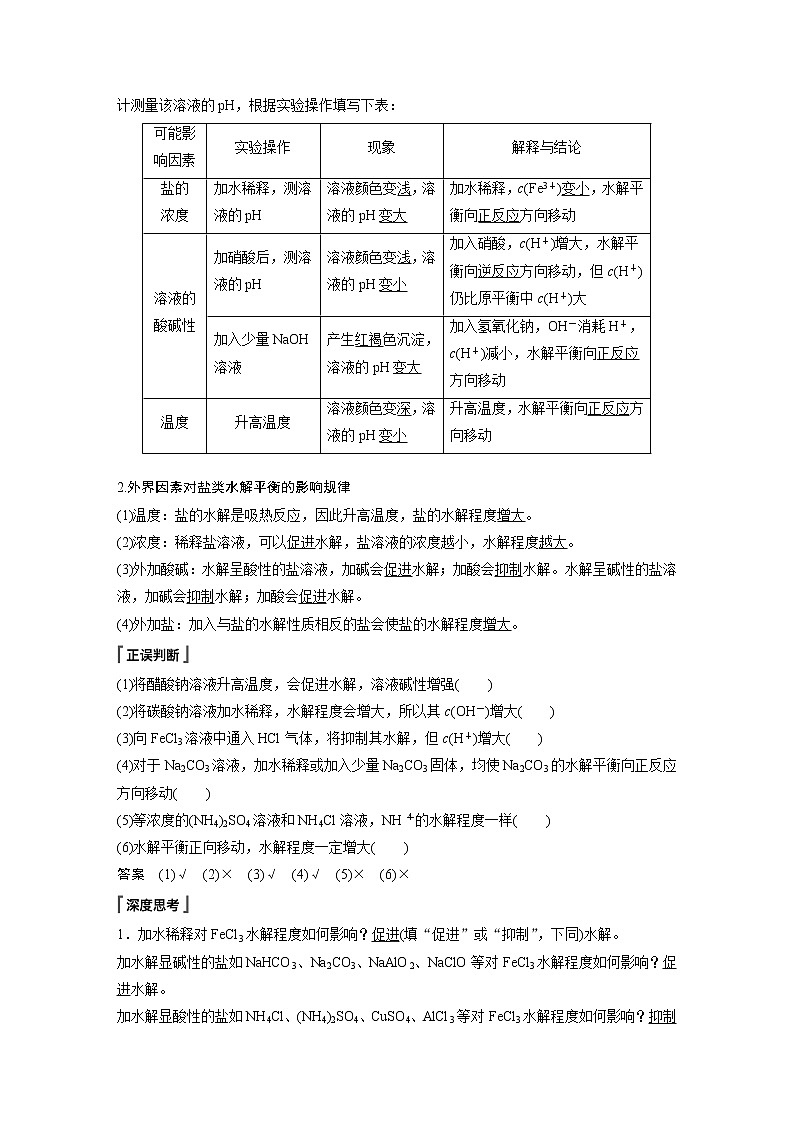
1.实验探究盐类水解平衡的影响因素
已知0.1 mol·L-1 Fe(NO3)3发生水解反应的离子方程式:Fe3++3H2OFe(OH)3+3H+,用pH计测量该溶液的pH,根据实验操作填写下表:
可能影响因素
实验操作
现象
解释与结论
盐的
浓度
加水稀释,测溶液的pH
溶液颜色变浅,溶液的pH变大
加水稀释,c(Fe3+)变小,水解平衡向正反应方向移动
溶液的酸碱性
加硝酸后,测溶液的pH
溶液颜色变浅,溶液的pH变小
加入硝酸,c(H+)增大,水解平衡向逆反应方向移动,但c(H+)仍比原平衡中c(H+)大
加入少量NaOH溶液
产生红褐色沉淀,溶液的pH变大
加入氢氧化钠,OH-消耗H+,c(H+)减小,水解平衡向正反应方向移动
温度
升高温度
溶液颜色变深,溶液的pH变小
升高温度,水解平衡向正反应方向移动
2.外界因素对盐类水解平衡的影响规律
(1)温度:盐的水解是吸热反应,因此升高温度,盐的水解程度增大。
(2)浓度:稀释盐溶液,可以促进水解,盐溶液的浓度越小,水解程度越大。
(3)外加酸碱:水解呈酸性的盐溶液,加碱会促进水解;加酸会抑制水解。水解呈碱性的盐溶液,加碱会抑制水解;加酸会促进水解。
(4)外加盐:加入与盐的水解性质相反的盐会使盐的水解程度增大。
(1)将醋酸钠溶液升高温度,会促进水解,溶液碱性增强( )
(2)将碳酸钠溶液加水稀释,水解程度会增大,所以其c(OH-)增大( )
(3)向FeCl3溶液中通入HCl气体,将抑制其水解,但c(H+)增大( )
(4)对于Na2CO3溶液,加水稀释或加入少量Na2CO3固体,均使Na2CO3的水解平衡向正反应方向移动( )
(5)等浓度的(NH4)2SO4溶液和NH4Cl溶液,NH的水解程度一样( )
(6)水解平衡正向移动,水解程度一定增大( )
答案 (1)√ (2)× (3)√ (4)√ (5)× (6)×
1.加水稀释对FeCl3水解程度如何影响?促进(填“促进”或“抑制”,下同)水解。
加水解显碱性的盐如NaHCO3、Na2CO3、NaAlO2、NaClO等对FeCl3水解程度如何影响?促进水解。
加水解显酸性的盐如NH4Cl、(NH4)2SO4、CuSO4、AlCl3等对FeCl3水解程度如何影响?抑制水解。
2.把还原性的盐如NaHSO3、Na2SO3等加入FeCl3溶液中,Fe3+的水解向逆反应(填“正反应”或“逆反应”)方向移动。
1.向三份0.1 mol·L-1 CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为___________________________________。
答案 减小、增大、减小
解析 CH3COO-水解显碱性,SO水解也呈碱性,会抑制CH3COO-的水解,使CH3COO-浓度增大。NH和Fe3+水解呈酸性,会促进CH3COO-水解,使CH3COO-浓度减小。
2.向纯碱溶液中滴入酚酞溶液。
(1)观察到的现象是______________,若微热溶液,观察到的现象是____________________,由此可证明碳酸钠的水解是__________(填“吸热”或“放热”)反应。
(2)Na2CO3溶液中____(填“大于”或“小于”)2,能使其比值接近2的措施有________(填序号)。
①加入适量盐酸 ②加入适量的NaOH溶液 ③加入适量的KOH溶液 ④加热 ⑤加入适量的KHCO3固体
答案 (1)溶液变红 溶液红色加深 吸热 (2)大于 ③⑤
分析盐类水解平衡移动时的注意事项
(1)盐类水解的影响规律
越弱越水解,越热越水解,越稀越水解,加酸碱抑制或促进水解。
(2)水解平衡正向移动,离子的水解程度不一定增大。若升高温度(或加水稀释)水解平衡正向移动,离子的水解程度增大,若增大离子的浓度使水解平衡正向移动,离子的水解程度反而减小。
(3)水解平衡移动,水解平衡常数不一定改变。水解平衡常数只与温度有关。
三、盐类水解的应用
1.在化学实验中的应用
应用
举例
判断溶液的酸碱性
FeCl3溶液显酸性,原因是Fe3++3H2OFe(OH)3+3H+
判断酸性强弱
相同浓度的NaX、NaY、NaZ溶液的pH分别为8、9、10,则酸性:HX>HY>HZ
配制或贮存易水解的盐溶液
配制CuSO4溶液时,加入少量H2SO4,抑制Cu2+水解;贮存Na2CO3溶液不能用磨口玻璃塞
胶体的制取
制取Fe(OH)3胶体的离子反应:Fe3++3H2OFe(OH)3(胶体)+3H+
制备无水盐
将易挥发性酸的弱碱盐(如AlCl3、FeCl3溶液)蒸干时,在通HCl的气流中加热蒸干
判断离子是否大量共存
Al3+与CO、HCO、S2-、HS-、AlO;Fe3+与HCO、CO、AlO;NH与AlO、SiO因相互促进水解而不能大量共存
2.在生产生活中的应用
泡沫灭火器原理
泡沫灭火器中主要成分为NaHCO3与Al2(SO4)3,发生的反应为Al3++3HCO===Al(OH)3↓+3CO2↑
作净水剂
明矾可作净水剂,原理为Al3++3H2OAl(OH)3(胶体)+3H+
化肥的使用
铵态氮肥与草木灰不能混合使用
除锈剂
NH4Cl溶液与ZnCl2溶液可作焊接时的除锈剂,原理为NH+H2ONH3·H2O+H+、Zn2++2H2OZn(OH)2+2H+
(1)热的纯碱溶液去污效果好,是因为加热促进了水解,c(OH-)增大( √ )
(2)盐溶液都可用磨口玻璃塞的试剂瓶保存( × )
(3)Al2(SO4)3溶液直接蒸干得不到Al2(SO4)3固体( × )
(4)由于CH3COO-和NH相互促进水解,所以没有CH3COONH4溶液( × )
1.实验室中如何用固体FeCl3配制FeCl3溶液?为什么?
提示 氯化铁晶体溶于较浓盐酸中,然后加水稀释到所需的浓度;抑制FeCl3水解。
2.实验室中如何用固体FeSO4配制FeSO4溶液?为什么?
提示 加少量稀硫酸和Fe粉;抑制FeSO4水解,防止FeSO4氧化。
3.NH4F溶液能否保存在玻璃试剂瓶中?为什么?
提示 不能; NH4F水解生成的氢氟酸腐蚀玻璃。
4.工业上通常在干燥的HCl气流中加热MgCl2· 6H2O获得无水MgCl2,干燥的HCl气流的作用是什么?
提示 ①干燥的HCl气流带走水,②HCl抑制MgCl2水解。
1.下列应用与盐类水解有关的是________(填序号)。
①NH4Cl溶液与ZnCl2溶液可作焊接金属时的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合使用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤实验室保存FeCl2溶液时,常加入少量的铁粉
⑥加热蒸干AlCl3溶液得到Al(OH)3固体
答案 ①②③④⑥
解析 ①中NH4Cl溶液与ZnCl2溶液水解均显酸性,可除去金属表面的锈;②HCO与Al3+水解相互促进,产生氢氧化铝和二氧化碳,可作灭火剂;③草木灰的主要成分是碳酸钾,水解显碱性,而铵态氮肥水解显酸性,因而不能混合使用;④碳酸钠溶液水解显碱性,而磨口玻璃塞中的二氧化硅会与碱反应生成硅酸钠将瓶塞与瓶口黏结,因此盛放碳酸钠的试剂瓶应用橡胶塞;⑤Fe2+易被O2氧化,为防止Fe2+被氧化常加入铁粉:Fe+2Fe3+===3Fe2+;⑥AlCl3溶液中存在水解平衡:AlCl3+3H2OAl(OH)3+3HCl,加热时,HCl挥发使平衡不断右移,最终得到Al(OH)3固体。
2.在蒸发皿中加热蒸干并灼烧(低于400 ℃)下列物质的溶液,可以得到原溶质的为________(填序号)。
①硫酸钠 ②氯化铝 ③碳酸氢钠 ④高锰酸钾 ⑤碳酸钠 ⑥亚硫酸钠 ⑦硫酸铁
答案 ①⑤⑦
解析 强酸强碱盐在溶液中不水解,蒸干后一般得原物质,故①可以;硫酸铁在水溶液中水解生成难挥发性的H2SO4,碳酸钠在溶液中水解生成强碱NaOH,故蒸干后也可以得到原物质,因此⑤和⑦可以;AlCl3发生水解反应:AlCl3+3H2OAl(OH)3+3HCl,加热时生成的HCl挥发而使水解平衡向右移动,致使生成Al(OH)3沉淀,它被灼烧得Al2O3,故②不能得到原溶质;NaHCO3、KMnO4受热后分解分别得到Na2CO3、K2MnO4和MnO2,因此③④不能得到原溶质;Na2SO3是还原性盐,在蒸干时会被O2氧化为Na2SO4,故⑥不能得到原固体。
分析蒸干盐溶液所得物质成分时应注意的问题
(1)盐水解后的酸能否挥发,碱是否为沉淀。
盐水解生成难挥发性酸或生成易溶于水的强碱时,蒸干后一般得到该盐,如MgSO4、Al2(SO4)3、Na2CO3等。
盐水解生成易挥发性酸,且生成难溶于水的弱碱时,蒸干(或灼烧)得到对应的弱碱沉淀(或氧化物),如AlCl3、FeCl3等。
(2)盐是否分解。如Ca(HCO3)2、NaHCO3、NH4Cl、KMnO4等受热易分解。
(3)盐能否发生氧化反应。如Na2SO3易被O2氧化为Na2SO4。
题组一 影响盐类水解平衡的因素
1.为了配制NH的浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )
①适量的HCl ②适量的NaCl ③适量的氨水 ④适量的NaOH
A.①② B.③ C.③④ D.④
答案 B
解析 NH4Cl溶液中存在NH+H2ONH3·H2O+H+,为增大NH浓度,应加入酸或NH3·H2O,①加入HCl虽然增大了H+的浓度,但也增大了Cl-的浓度,不符合题目要求。
2.(2020·广州调研)下列关于FeCl3水解的说法错误的是( )
A.在FeCl3稀溶液中,水解达到平衡时,无论加FeCl3饱和溶液还是加水稀释,平衡均正向移动
B.浓度为5 mol·L-1和0.5 mol·L-1的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者小于后者
C.其他条件相同时,同浓度的FeCl3溶液在50 ℃和20 ℃时发生水解,50 ℃时Fe3+的水解程度比20 ℃时的小
D.为抑制Fe3+的水解,更好地保存FeCl3溶液,应加少量盐酸
答案 C
解析 增大FeCl3的浓度,水解平衡正向移动,但Fe3+水解程度减小,加水稀释,水解平衡正向移动,Fe3+水解程度增大,A、B项均正确;盐类水解是吸热过程,温度升高,水解程度增大,C项错误;Fe3+水解后溶液呈酸性,增大H+的浓度可抑制Fe3+的水解,D项正确。
3.对滴有酚酞溶液的下列溶液进行操作后颜色变深的是( )
A.明矾溶液加热
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体
D.小苏打溶液中加入少量NaCl固体
答案 B
解析 明矾溶液中Al3+水解,溶液呈酸性,加热水解平衡向右移动,c(H+)增大,溶液仍无色,A项错误;CH3COONa溶液呈碱性,加热促进水解,溶液碱性增强,溶液红色加深,B项正确;氨水中加入少量NH4Cl,抑制NH3·H2O的电离,溶液红色变浅,C项错误;小苏打溶液呈弱碱性,加入NaCl固体对溶液酸碱性无影响,D项错误。
题组二 盐溶液蒸干(灼烧)产物的判断
4.在空气中直接蒸发下列盐的溶液:①Fe2(SO4)3;②Na2CO3;③KCl;④CuCl2;⑤NaHCO3。可以得到相应盐的晶体(可以含有结晶水)的是( )
A.①②③ B.①③⑤ C.②④ D.①③④⑤
答案 A
解析 ①加热Fe2(SO4)3溶液时虽发生水解,但硫酸难挥发,蒸发Fe2(SO4)3溶液可得到Fe2(SO4)3晶体;③KCl性质稳定,加热其溶液可得到KCl晶体;④加热CuCl2溶液水解生成氢氧化铜和HCl,HCl易挥发,得到氢氧化铜晶体;⑤NaHCO3不稳定,加热易分解生成Na2CO3。
5.为了得到比较纯净的物质,使用的方法恰当的是( )
A.向Na2CO3饱和溶液中通入过量的CO2后,在加压、加热的条件下,蒸发得到NaHCO3晶体
B.Al2S3不能用复分解反应的方法在溶液中制取,而只能由S粉和Al粉混合加热制得
C.向FeBr2溶液中加入过量的氯水,加热蒸发得到FeCl3晶体
D.向FeCl3溶液中加入过量的NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得到Fe3O4
答案 B
解析 A项不恰当,因为NaHCO3加热易分解;B项恰当,铝离子和硫离子之间双水解会得到氢氧化铝和硫化氢,Al2S3不能通过溶液中的反应制取;C项不恰当,因为加入过量氯水,发生反应:2FeBr2+3Cl2===2FeCl3+2Br2,存在平衡:FeCl3+3H2OFe(OH)3+3HCl,加热蒸发时,Br2、HCl挥发,促进水解向右进行,得到Fe(OH)3,Fe(OH)3受热分解生成Fe2O3;D项不恰当,FeCl3与NaOH反应生成Fe(OH)3,Fe(OH)3加热分解生成Fe2O3。
题组三 盐类水解对离子共存的影响
6.下列离子组一定不能大量共存的是( )
A.K+、Na+、CO、NO
B.NH、Cl-、NO、Na+
C.Al3+、HCO、NO、Cl-
D.SiO、Na+、K+、NO
答案 C
解析 A项,四种离子相互之间不能反应,能大量共存;C项,由于Al3+、HCO相互促进水解生成沉淀和气体,不能大量共存。
7.下列离子因发生相互促进的水解反应而不能大量共存的是( )
A.K+、S2-、Al3+、AlO
B.MnO、Na+、SO、K+
C.SO、Fe3+、S2-、K+
D.Fe2+、Cl-、H+、NO
答案 A
解析 A项,Al3+与S2-、AlO能发生双水解反应;C中的Fe3+与S2-和D中的Fe2+、H+、NO都因为发生氧化还原反应而不能大量共存。
题组四 盐类水解的综合应用
8.下列说法正确的是( )
A.用NaOH溶液调节pH除去NH4Cl溶液中的FeCl3
B.除去油污常用热的Na2CO3溶液
C.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
D.将AlCl3溶液和Na2SO3溶液分别加热、蒸干、灼烧后,所得固体为Al2O3和Na2SO3
答案 B
解析 因为NH4Cl和FeCl3都可以与NaOH反应,所以不能用NaOH溶液调节pH除去NH4Cl溶液中的FeCl3,故A错误;Na2CO3水解呈碱性,油污在碱性条件下可水解,加热促进Na2CO3的水解,有利于除去油污,故B正确;FeSO4易水解,配制其溶液时应将FeSO4固体溶于H2SO4溶液中,故C错误;AlCl3水解生成Al(OH)3和HCl,HCl易挥发,加热、蒸干、灼烧后,得到Al2O3,Na2SO3具有还原性,在加热过程中易被氧化为Na2SO4,Na2SO4是强酸强碱盐,不水解,也不易分解,灼烧后得到的固体是Na2SO4,故D错误。
9.为使Na2S溶液中的值减小,可加入的物质是( )
①盐酸 ②适量的NaOH固体 ③适量的KOH固体 ④适量的KHS固体
A.①② B.②③ C.③④ D.①④
答案 C
解析 在Na2S溶液中存在S2-+H2OHS-+OH-。①中加入盐酸,H+中和OH-,水解平衡右移,c(S2-)减小,的值增大;②中加入适量的NaOH固体,c(OH-)增大,平衡左移,c(S2-)增大,但c(Na+)增大的更多,故的值增大;③中加入适量的KOH固体,c(OH-)
增大,平衡左移,n(S2-)增大而n(Na+)不变,故的值减小;④中加入适量的KHS固体,c(HS-)增大,平衡左移,n(S2-)增大而n(Na+)不变,故的值减小。
10.等物质的量浓度的下列溶液中c(NH)由多到少的关系正确的是( )
①NH4Cl ②NH4HSO4 ③CH3COONH4 ④NH4Al(SO4)2 ⑤NH3·H2O ⑥(NH4)2SO4
A.①②③④⑤⑥ B.④⑥②①③⑤
C.②①③④⑤⑥ D.⑥②④①③⑤
答案 D
解析 ①NH4Cl===NH+Cl-;②NH4HSO4===NH+H++SO;③CH3COO-+H2OCH3COOH+OH-,促进NH的水解;④NH4Al(SO4)2===NH+Al3++2SO,Al3++3H2OAl(OH)3+3H+,抑制NH水解;⑤NH3·H2ONH+OH-,NH3·H2O只有少部分电离;⑥(NH4)2SO4===2NH+SO。
11.(2020·宁波模拟)已知BeCl2+Na2BeO2+2H2O===2NaCl+2Be(OH)2↓,下列说法正确的是( )
A.BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物是BeCl2
B.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
C.BeCl2水溶液的导电性强,故BeCl2是离子化合物
D.工业上可以用电解熔融BeCl2的方法冶炼金属Be
答案 B
解析 在元素周期表中,Be和Al处于对角线位置,它们有些性质是相似的。A项,由氯化铝水解显酸性,且水解生成的盐酸易挥发,可知BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物为BeO,错误;B项,氢氧化铝具有两性,则Be(OH)2既能溶于盐酸,又能溶于NaOH溶液,正确;C项,氯化铝为共价化合物,则BeCl2也是共价化合物,错误;D项,工业上可以用电解熔融氧化铝的方法冶炼金属铝,则工业上可以用电解熔融BeO的方法冶炼金属Be,错误。
12.把NH4Cl晶体溶入水中,得到饱和NH4Cl溶液。
(1)若在该溶液中加入镁条,观察到有气泡产生,点燃有爆鸣声,此气体是________,产生该气体的原因是______________________________________________(用离子方程式表示)。
(2)微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是________,产生该气体的原因是________________________________________________。
(3)总反应的离子方程式为______________________________________________________。
答案 (1)H2 NH+H2ONH3·H2O+H+、Mg+2H+===Mg2++H2↑ (2)NH3 c(H+)减小,使水解平衡右移,产生的NH3·H2O增多,加热使NH3·H2O分解放出NH3 (3)Mg+2NHMg2++H2↑+2NH3↑
13.如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为________________________。
(2)实验过程中发现烧杯①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是________(填字母)。
A.水解反应为放热反应
B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量
D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1 CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为________、________、________、________(填“向左”“向右”或“不移动”)。
答案 (1)CH3COO-+H2OCH3COOH+OH-,溶液显碱性 (2)BD (3)向右 向左 向左 向右
解析 (1)CH3COONa中CH3COO-水解使溶液显碱性,碱性溶液使酚酞显红色。(2)生石灰与水反应放出大量的热,根据烧瓶①中溶液的红色变深,判断水解平衡向右移动,说明水解反应是吸热的,同时烧瓶③中溶液红色变浅,则NH4NO3溶于水时吸收热量。(3)酸促进CH3COO-
的水解;碱抑制CH3COO-的水解;CO与CH3COO-水解相互抑制;Fe2+与CH3COO-水解相互促进。
14.(2020·杭州高二期中)“烂板液”指的是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量Cl-、Fe3+)。某化学兴趣小组用“烂板液”制取Zn(NO3)2·6H2O的过程如图:
已知:Zn(NO3)2·6H2O是一种无色晶体,其水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂板液”中溶质的主要成分是________(填化学式)。
(2)在操作①中保持pH=8的目的是______________________________________________
____________________________________________________________________________。
(3)沉淀Ⅰ的主要成分是________________(填化学式)。
(4)操作③中加热煮沸的目的是________________________;此步操作的理论依据是____________________________________________________________________________。
(5)操作④保持pH=2的目的是__________________________________________________;
此步操作中加热所用的主要仪器是_______________________________________________。
答案 (1)Zn(NO3)2
(2)防止生成的Zn(OH)2沉淀被溶解
(3)Zn(OH)2和Fe(OH)3
(4)促使Fe3+完全水解 温度越高,水解程度越大
(5)抑制Zn2+水解 蒸发皿、酒精灯、铁架台、玻璃棒
解析 (1)由题意知,“烂板液”指的是稀硝酸腐蚀锌板后得到的“废液”,所以“烂板液”中溶质的主要成分应为Zn(NO3)2。(2)因为Zn(OH)2具有两性,能与强碱反应,故操作①中保持pH=8的目的是防止生成的Zn(OH)2沉淀被溶解。(3)在碱性条件下,Fe3+、Zn2+都会转化为氢氧化物沉淀,所以沉淀Ⅰ的主要成分为Zn(OH)2和Fe(OH)3。(4)操作③是为了分离Zn2+和Fe3+,故加热煮沸是为了促使Fe3+完全水解。(5)由题意知,Zn(NO3)2是一种强酸弱碱盐,易水解,故保持pH=2的目的是抑制Zn2+水解。
化学选择性必修1第三单元 盐类的水解第2课时导学案: 这是一份化学选择性必修1第三单元 盐类的水解第2课时导学案,共13页。学案主要包含了新知预习,即学即练等内容,欢迎下载使用。
2021学年第三章 水溶液中的离子反应与平衡第三节 盐类的水解导学案: 这是一份2021学年第三章 水溶液中的离子反应与平衡第三节 盐类的水解导学案,共19页。学案主要包含了水解平衡常数,影响盐类水解的因素,盐类水解的应用,判断盐溶液蒸干时所得的产物等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第三单元 盐类的水解学案设计: 这是一份苏教版 (2019)选择性必修1第三单元 盐类的水解学案设计,共16页。学案主要包含了影响盐类水解平衡的因素,盐类水解的应用等内容,欢迎下载使用。













