



人教版 (新课标)选修4 化学反应原理第三节 化学平衡教课课件ppt
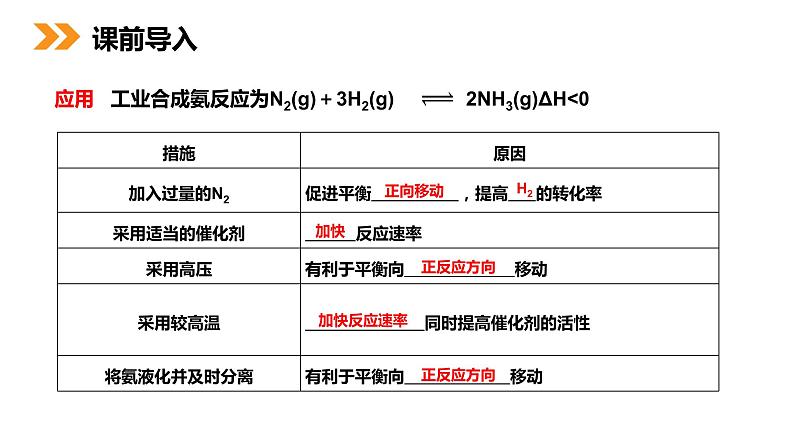
展开应用 工业合成氨反应为N2(g)+3H2(g) 2NH3(g)ΔH<0
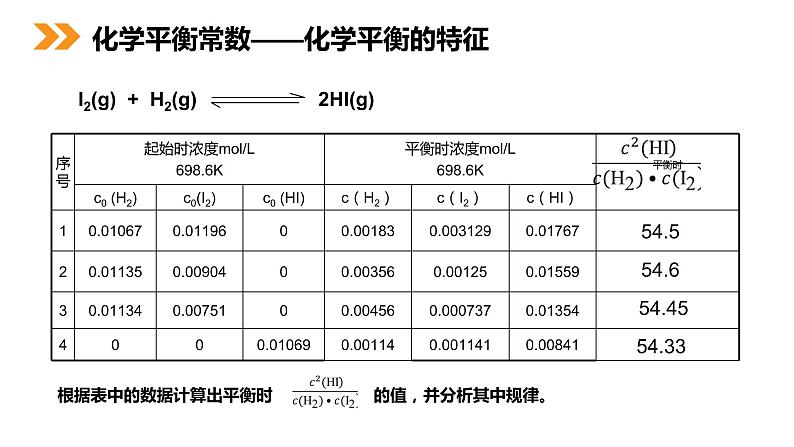
根据表中的数据计算出平衡时 的值,并分析其中规律。
化学平衡常数——化学平衡的特征
通过分析实验数据得出:1、温度不变时, 为常数 用K表示;2、常数K与反应的起始浓度大小无关;3、常数K与正向建立还是逆向建立平衡无关即与平衡建立的过程无关。
思维建模:其它平衡体系的数据进行分析,都有类似的关系。
(1)定义:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),符号用“K”表示。
1、化学平衡常数、定义、数学表达式、单位
化学平衡常数只与反应本身及温度有关,与压强、起始浓度、起始反应方向均无关。
∴K的单位为(ml·L-1)n;
n=(p+q)-(m+n)
∵浓度的单位为ml·L-1
※当浓度的单位为 ml·L-1,称标准平衡常数,标准平衡常数不写单位
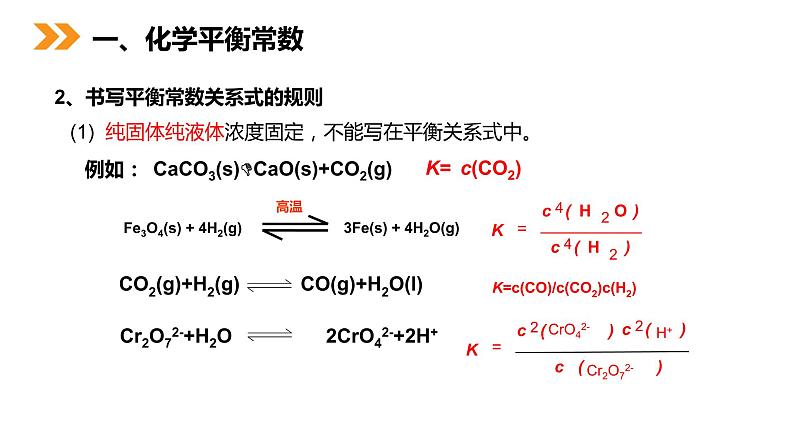
(1) 纯固体纯液体浓度固定,不能写在平衡关系式中。
CaCO3(s)CaO(s)+CO2(g)
2、书写平衡常数关系式的规则
Cr2O72-+H2O 2CrO42-+2H+
K=c(CO)/c(CO2)c(H2)
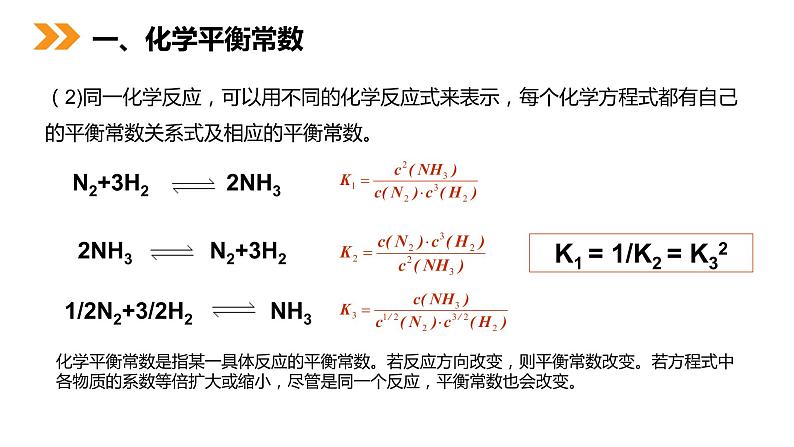
(2)同一化学反应,可以用不同的化学反应式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。
K1 = 1/K2 = K32
化学平衡常数是指某一具体反应的平衡常数。若反应方向改变,则平衡常数改变。若方程式中各物质的系数等倍扩大或缩小,尽管是同一个反应,平衡常数也会改变。
(3)多重平衡规则:若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商)例 2NO (g) + O2 (g) 2NO2 (g) K1 2NO2 (g) N2O4 (g) K2 2NO (g) +O2(g) N2O4 (g)
K = K1 K2
(1)平衡常数K与温度有关,与浓度无关,由K随温度的变化可推断正反应是吸热反应还是放热。若正反应是吸热反应,升高温度,K 增大;若正反应是放热反应,升高温度,K 减小。
通过改变温度,平衡常数大小的变化趋势可以判断上可逆反应的正方向是放热反应.
(2)平衡常数K值的大小,可推断反应进行的程度。 K 值越大,表示反应进行的程度越大,反应物的转化率越大;K 值越小,表示反应进行的程度越小,反应物的转化率越小。
(3)反应的平衡常数与反应可能进行的程度。一般来说,反应的平衡常数K≥105,认为正反应进行得较完全;K ≤10-5则认为这个反应的正反应很难进行(逆反应较完全)。
(4)在某温度下,某时刻反应是否达平衡,可用该时刻产物的浓度幂的之积与反应物浓度幂之积的比即浓度商Q与K比较大小来判断。
(5)另外还有两点必须指出: ①平衡常数数值的大小,只能大致告诉我们一个可逆反应的正向反应所进行的最大程度,并不能预示反应达到平衡所需要的时间。如:2SO2(g)+O2 2SO3(g) 298K时K很大,但由于速度太慢,常温时,几乎不发生反应。 ②平衡常数数值极小的反应,说明正反应在该条件下不可能进行,如: N2+O2 2NO K=10-30(298K)所以常温下用此反应固定氮气是不可能的。因此没有必要在该条件下进行实验,以免浪费人力物力。或者改变条件使反应在新的条件下进行比较好一些。
4、有关化学平衡常数的计算
注意:各物质的转化浓度之比等于它们在化学方程式中相应的化学计量数之比。△c(A): △c(B): △c(C): △c(D)=a:b:c:d
c0(A) -△c(A)
c0(B) -△c(B)
c0(C) +△c(C)
c0(D)+△c(D)
用平衡常数来表示反应的限度有时不够直观,常用平衡转化率α来表示反应限度。
反应物A的平衡转化率(该条件最大转化率)可表示:
1、关于化学平衡常数的叙述中,正确的是( ) A.只与化学反应方程式本身和温度有关 B.只与反应的温度有关 C.与化学反应本身和温度有关,并且会受到起始浓度的影响 D.只与化学反应本身有关,与其他任何条件无关的一个不变的常数
2.反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)的平衡常数表达式正确的是( )A.K=n2(NH3)·n(CO2)(n(H2O))B.K=n(H2O)(n2(NH3)·n(CO2))C.K=c2(NH3)·c(CO2)(c[CO(NH2)2]·c(H2O))D.K=c2(NH3)·c(CO2)(c(H2O))
3.高温下,某反应达平衡,平衡常数K=[c(CO)·c(H2O)]/[c(CO2)·c(H2)]。恒容时,温度升高,H2浓度减小。下列说法正确的是 ( )A.该反应的焓变为正值 B.恒温恒容下,增大压强,H2浓度一定减小C.升高温度,逆反应速率减小 D.该反应的化学方程式为CO+H2O⇌CO2+H2
4.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s) NH3(g) + HI(g)②2HI(g) H2(g) + I2(g)达到平衡时,c(H2) = 0.5 ml/L,c(HI) = 4 ml/L,则此温度下反应①的平衡常数为( ) A.9 ml2•L–2 B.16 ml2•L–2 C.20 ml2•L–2 D.25 ml2•L–2
⑴、物质浓度的变化关系:
①、反应物:平衡浓度= ————————————————
②、生成物:平衡浓度= ————————————————
③、各物质的变化浓度之比= ————————————————
⑵、反应物的转化率:反应物转化为生成物的百分率
二、有关化学平衡的计算:
① ∵2 : x = 2 : (0.1×5×4)
例2、加热N2O5时,发生下列两个分解反应: N2O5 N2O3+O2 , N2O3 N2O+ O2;在1L密闭容器中加热4ml N2O5达到化学平衡时O2的浓度为4.50 ml/L, N2O3的浓度为1.62 ml/L,求其他各物质的平衡浓度。
N2O5 N2O3+O2
N2O3 N2O+O2
1、700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g)反应过程中测定的部分数据见右表(表中t2>t1)下列说法正确的是( )A.反应在t1 min内的平均速率为v(H2)=0.40/t1 ml·L-1·min-1B.保持其他条件不变,起始时充入0.60 ml CO和1.20 ml H2O,达平衡时n(CO2)=0.40 mlC.保持其他条件不变,向平衡体系中再通入0.20 ml H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小D.温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
2、25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是 ( )A.往平衡体系中加入金属铅后,c(Pb2+)增大B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0D.25 ℃时,该反应的平衡常数K=2.2
高中人教版 (新课标)第四章 电化学基础综合与测试课文内容ppt课件: 这是一份高中人教版 (新课标)第四章 电化学基础综合与测试课文内容ppt课件,共22页。PPT课件主要包含了学习目标,⑴两个电极,⑶形成闭合回路,温故知新,有关电解,实验探究,以电解氯化铜溶液为例,离子放电顺序,CuCl2,CuCl2溶液等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第一节 原电池集体备课课件ppt: 这是一份人教版 (新课标)选修4 化学反应原理第一节 原电池集体备课课件ppt,共21页。PPT课件主要包含了学习目标,ADF,活泼性不同,电解质,原电池工作原理,失电子,得电子,阴离子移向负极,阳离子移向正极,KCl饱和溶液等内容,欢迎下载使用。
高中化学第二节 化学电源教案配套ppt课件: 这是一份高中化学第二节 化学电源教案配套ppt课件,共25页。PPT课件主要包含了学习目标,化学电池,一次电池,二次电池,燃料电池,碱性锌锰电池,铅蓄电池,氢氧燃料电池,锂离子电池,银锌蓄电池等内容,欢迎下载使用。













