







高中化学苏教版 (2019)必修 第一册第一单元 元素周期律和元素周期表授课课件ppt
展开1.原子序数(1)概念:化学家按照① 核电荷数 由小到大的顺序给元素依次编号,这种编号叫作原子序数。(2)数量关系:原子序数=② 核电荷数 =质子数=③ 核外电子数 。
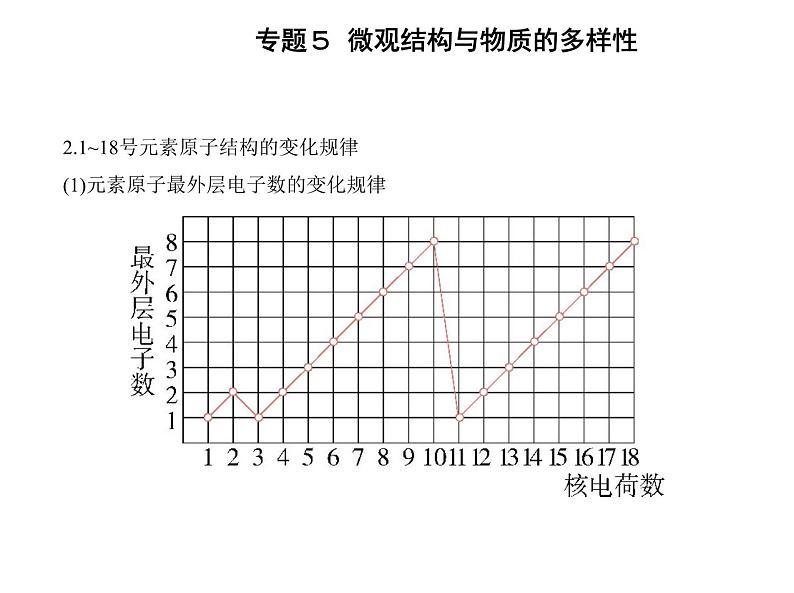
2.1~18号元素原子结构的变化规律(1)元素原子最外层电子数的变化规律
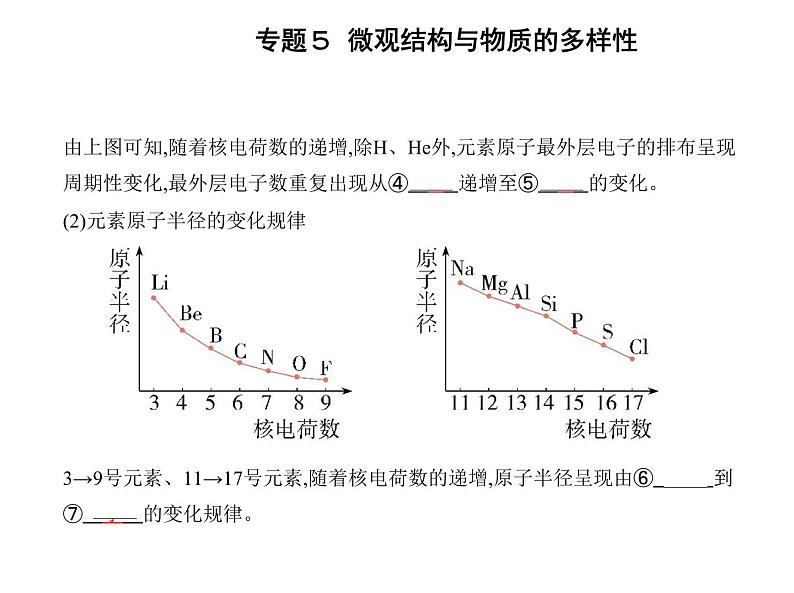
由上图可知,随着核电荷数的递增,除H、He外,元素原子最外层电子的排布呈现 周期性变化,最外层电子数重复出现从④ 1 递增至⑤ 8 的变化。(2)元素原子半径的变化规律 3→9号元素、11→17号元素,随着核电荷数的递增,原子半径呈现由⑥ 大 到 ⑦ 小 的变化规律。
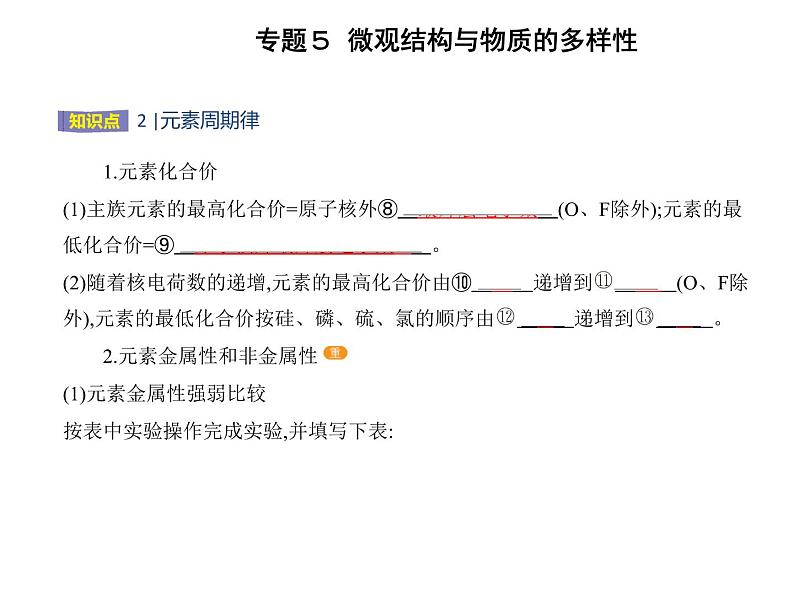
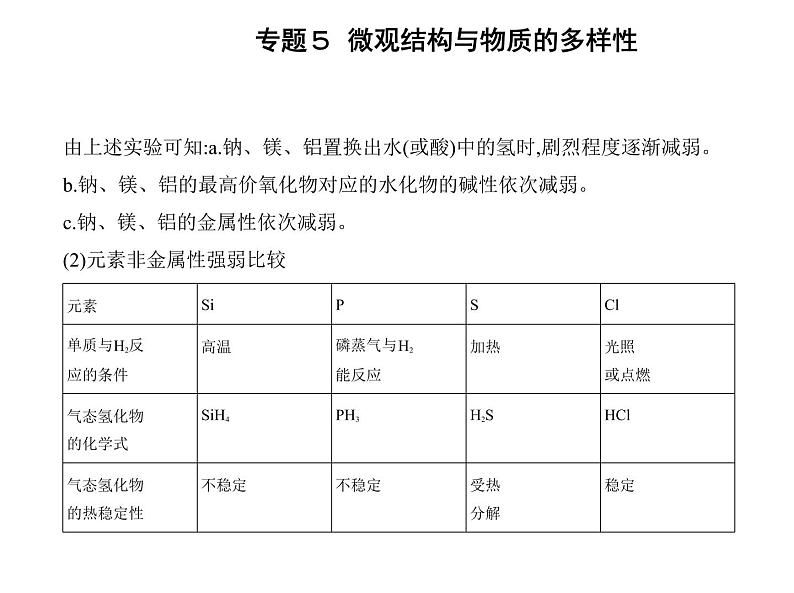
1.元素化合价(1)主族元素的最高化合价=原子核外⑧ 最外层电子数 (O、F除外);元素的最 低化合价=⑨ 原子核外最外层电子数-8 。(2)随着核电荷数的递增,元素的最高化合价由⑩ +1 递增到 +7 (O、F除外),元素的最低化合价按硅、磷、硫、氯的顺序由 -4 递增到 -1 。 2.元素金属性和非金属性 (1)元素金属性强弱比较按表中实验操作完成实验,并填写下表:
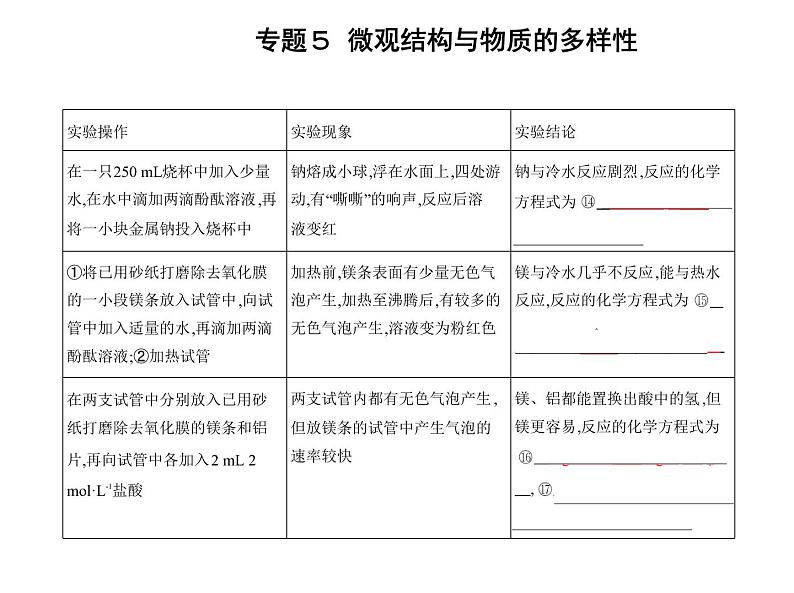
由上述实验可知:a.钠、镁、铝置换出水(或酸)中的氢时,剧烈程度逐渐减弱。b.钠、镁、铝的最高价氧化物对应的水化物的碱性依次减弱。c.钠、镁、铝的金属性依次减弱。(2)元素非金属性强弱比较
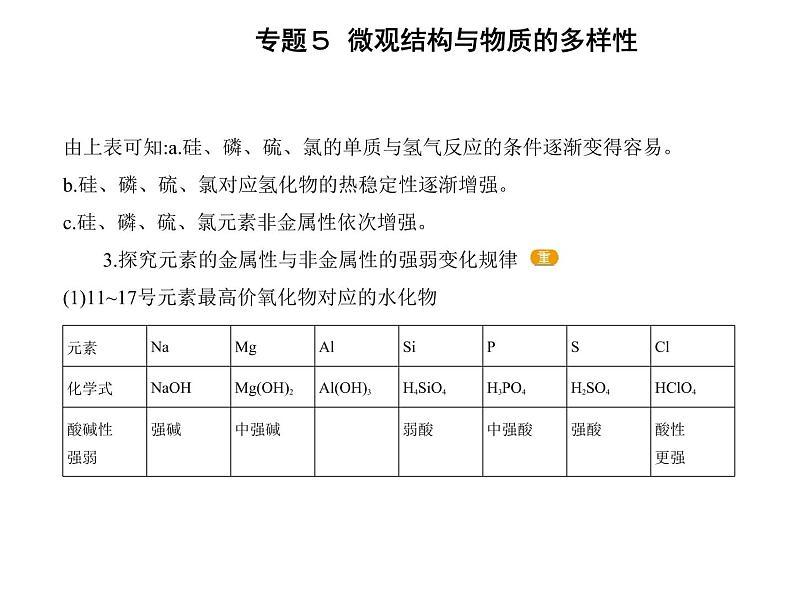
由上表可知:a.硅、磷、硫、氯的单质与氢气反应的条件逐渐变得容易。b.硅、磷、硫、氯对应氢化物的热稳定性逐渐增强。c.硅、磷、硫、氯元素非金属性依次增强。 3.探究元素的金属性与非金属性的强弱变化规律 (1)11~17号元素最高价氧化物对应的水化物
从表中分析可知11~17号元素最高价氧化物对应的水化物从左到右,碱性逐渐 减弱 ,酸性逐渐 增强 。11~17号元素从左到右,金属性逐渐 减弱 ,非金属性逐渐 增强 。(2)在两支洁净的试管中分别加入2~3 mL 2 ml·L-1的AlCl3溶液,逐滴加入稀氨水 至过量,观察到产生白色沉淀,反应的化学方程式是 AlCl3+3NH3·H2O Al(OH)3↓+3NH4Cl 。向一支试管中逐滴滴入6 ml·L-1的盐酸,观察到白色沉淀逐 渐溶解,得到澄清溶液,反应的化学方程式为 Al(OH)3+3HCl AlCl3+3H2O 。向另一支试管中逐滴加入6 ml·L-1的NaOH溶液,边滴加边振荡,观察到白色 沉淀逐渐溶解,得到澄清溶液,反应的化学方程式为 Al(OH)3+NaOH NaAlO2+2H2O 。实验表明:Al(OH)3既可以与盐酸反应,又可以与氢氧化钠溶液反应,为 两性氢氧化物 。
4.元素周期律(1)概念:元素的性质随着元素核电荷数的递增呈周期性变化的规律叫作元素周 期律。(2)内容:随着元素核电荷数的递增,元素的原子半径(稀有气体元素除外)、元素的 金属性和非金属性、元素的主要化合价都呈现周期性变化。(3)实质:元素性质的周期性变化是元素原子 核外电子排布 随着元素核电荷数的递增发生周期性变化的必然结果。
1.元素周期表的结构(1)元素周期表的编排原则
(2)元素周期表的结构
2.主族元素性质的递变规律 同主族元素的原子最外层电子数相同,随着核电荷数递增,电子层数逐渐增加,原 子半径逐渐增大,原子失去电子的能力逐渐增强,获得电子的能力逐渐减弱,元素 的金属性逐渐增强,非金属性逐渐减弱。 1.帮助我们更好地学习和研究化学元素的原子结构决定了元素在周期表中的位置,而元素在周期表中的位置反映了 元素的原子结构和元素的性质特点,我们可以根据元素在周期表中的位置,推测 元素的原子结构,预测未知元素的 主要性质 。 2.借助元素周期表制备有特定性质的新物质(1)在金属和非金属的分界线附近寻找半导体材料,如 锗、硒、硅 等。(2)在过渡元素( 副族和Ⅷ族 )中寻找各种优良的催化剂和耐高温、耐腐蚀的合金材料。 3.有效地指导人们寻找新材料和稀有矿产
1.通常情况下,元素的金属性越强,它的单质越容易从水或酸中置换出氢,该元素 最高价氧化物的水化物的碱性越强;元素的非金属性越强,它的单质越容易与氢 气反应形成气态氢化物,气态氢化物越稳定,该元素最高价氧化物的水化物的酸 性越强 ( √ )2.元素在周期表中的位置(周期序数与族序数)是由元素原子的电子层数与最外 层电子数决定的。同周期主族元素原子的半径随主族序数的增大而减小;同主族 元素原子的半径随周期序数的增大而增大 ( √ )3.第二周期主族元素从左到右,最高正价从+1递增到+7。元素的原子得电子越 多,非金属性越强;失电子越多,金属性越强 ( ✕ )提示:氧元素没有最高正价,氟元素没有正化合价。元素的非金属性、金属性强 弱与得失电子的难易程度有关,与得失电子多少无关。4.元素的氧化物对应的水化物酸性越强,非金属性越强 ( ✕ )5.ⅠA族元素都是碱金属元素 ( ✕ )
在门捷列夫时代,没有任何原子结构的知识,已知元素只有63种,元素大家族的信 息并不完整,门捷列夫敏感地认识到当时已知的63种元素远非整个元素大家庭, 大胆地预言了11种尚未发现的元素,为它们在相对原子质量序列中留下空位,预 言了它们的性质,并于1869年发表了第一张元素周期表。1913年,英国物理学家 莫斯莱发现,门捷列夫周期表里的原子序数原来是原子的核电荷数。从此,元素 周期律被表述为元素的性质随核电荷数递增发生周期性的递变。
问题1.为什么将Li、Na、K等元素编在元素周期表的同一主族?提示:最外层电子数相同的主族元素属于同一主族。2.最外层电子数是2的元素一定是ⅡA族元素吗?提示:不一定。如He最外层电子数为2,但为0族元素。
3.原子序数为x的元素位于元素周期表中的第ⅡA族,则原子序数为x+1的元素位 于元素周期表的哪一族?提示:ⅢA族或ⅢB族。原子序数为x+1的元素应位于ⅡA族右侧相邻的族,在短周 期中为ⅢA族,在长周期中为ⅢB族。
根据原子序数确定元素位置的方法——稀有气体定位法(1)0族元素
(2)根据原子序数判断元素位置的方法a.比大小定周期比较该元素的原子序数与0族元素的原子序数大小,找出与其相近的0族元素,那 么该元素就和序数大的0族元素处于同一周期。b.求差值定族数若某元素原子序数比相应的0族元素多1或2,则该元素应处在0族元素所在周期的 下一个周期的ⅠA族或ⅡA族。若比相应的0族元素少1~5 时,则应处在同周期的 ⅦA~ⅢA族。若相差其他数,则由相应差数找出相应的族。
建立“位、构、性”关系模型根据原子或离子的结构示意图推断①已知原子结构示意图,则电子层数=周期序数,最外层电子数=族序数。如果已知离子的结构示意图,则须将其转化为原子结构示意图来确定。②电子层结构相同的微粒:阴离子对应的元素在具有相同电子层结构的稀有气体 元素的前面,阳离子对应的元素在具有相同电子层结构的稀有气体元素的下一周 期的左边位置,简称“阴前阳下”。
(2021辽宁大连高一期末)类比和推理是化学研究的重要方法。下列说法正确的 是 ( )A.卤素单质的熔点从F2到I2逐渐升高,则碱金属单质的熔点从Li到Cs逐渐升高B.117号Ts的最低化合价为-1C.铊和铝同一主族,则铊的最高价氧化物对应的水化物Tl(OH)3为两性D.周期表中碲与硫同主族,相对原子质量大,则碲化氢是比硫化氢更稳定的气体
2020-2021学年专题5 微观结构与物质的多样性第一单元 元素周期律和元素周期表教案配套ppt课件: 这是一份2020-2021学年专题5 微观结构与物质的多样性第一单元 元素周期律和元素周期表教案配套ppt课件,共33页。PPT课件主要包含了分点突破1,分点突破2等内容,欢迎下载使用。
苏教版 (2019)专题5 微观结构与物质的多样性第一单元 元素周期律和元素周期表授课课件ppt: 这是一份苏教版 (2019)专题5 微观结构与物质的多样性第一单元 元素周期律和元素周期表授课课件ppt,共17页。
高中化学苏教版 (2019)必修 第一册第一单元 元素周期律和元素周期表课文配套课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册第一单元 元素周期律和元素周期表课文配套课件ppt,共44页。PPT课件主要包含了学业基础,核心素养,学考评价,图说考点,元素周期律,电子层数,原子序数,最外层电子数,同主族上→下,金属性等内容,欢迎下载使用。













