






还剩43页未读,
继续阅读
所属成套资源:苏教版化学必修第一册PPT课件整册
成套系列资料,整套一键下载
高中化学苏教版必修一 5.1.4 元素周期表的应用 课件
展开
这是一份高中化学苏教版必修一 5.1.4 元素周期表的应用 课件,共51页。
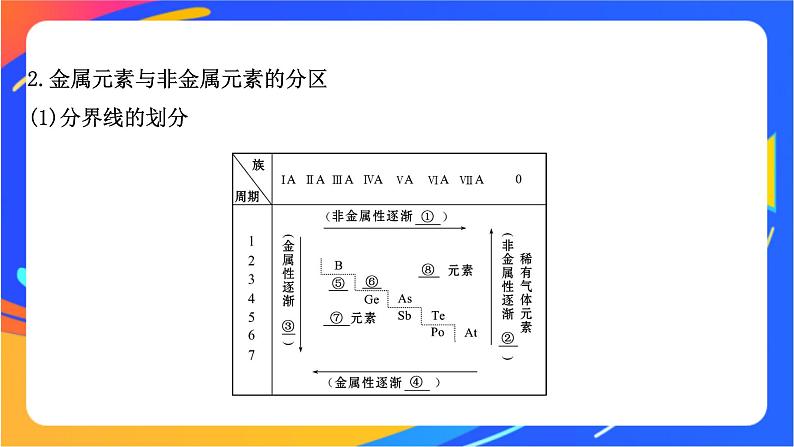
第4课时 元素周期表的应用专题5 微观结构与物质的多样性第一单元 元素周期律和元素周期表学习目标1.了解元素周期表与元素周期律的应用。2.体会元素周期表在学习元素及其化合物知识及科学研究中的重要作用。元素周期表的应用1.元素金属性与非金属性递变规律(1)同周期(从左到右),核电荷数逐渐增大,原子半径逐渐_____,失电子能力减弱,得电子能力增强,____________________________。(2)同主族(自上而下),核电荷数逐渐增大,原子半径逐渐_____,失电子能力增强,得电子能力减弱,____________________________。(3)元素周期表中左下方是金属性最强的元素___,右上方是非金属性最强的元素___。碱性最强的是_____,酸性最强的含氧酸是_____。必备知识·自主学习减小元素金属性减弱,非金属性增强增大元素金属性增强,非金属性减弱铯氟CsOHHClO4知识梳理2.金属元素与非金属元素的分区(1)分界线的划分请填写出图中序号所表示的内容:①_____ ②_____ ③_____ ④_____ ⑤___ ⑥___⑦_____ ⑧_______(2)分界线附近元素的性质:既能表现出一定的_______,又能表现出一定的__________。增强增强增强增强AlSi金属非金属金属性非金属性3.元素周期律和元素周期表的应用(1)根据元素在周期表中的位置推测其_________和_____。(2)根据元素的_________推测它在周期表中的位置。(3)指导新元素的发现及预测它们的_______________。(4)指导其他与化学相关的科学技术。①在周期表中___________________,可以找到半导体材料。②在_________中寻找催化剂和耐高温、耐腐蚀的合金材料。③在元素周期表的___________________,寻找制备农药的元素。原子结构性质原子结构原子结构和性质金属与非金属分界处过渡元素氟、氯、硫、磷附近【自主探索】铊位于第六周期第ⅢA族,铊元素在研究光导纤维、催化剂和超导材料等方面具有重要作用。在第二次世界大战期间,氯化铊的混合晶体就曾被用来传送紫外线,深夜进行侦察敌情或自我内部联络。元素铊的相关信息如图所示。根据卡片信息回答下列问题:请预测:(1)铊单质的颜色可能是:________。 (2)铊单质的熔点比Al________。 (3)铊的最高价氧化物对应水化物的碱性比氢氧化铝强还是弱?请说明理由。【解析】(1)铝单质是银白色的,故铊的颜色可能是银白色。(2)同主族金属单质的熔点从上到下逐渐降低,故铊单质的熔点比Al低。(3)铊的最高价氧化物对应水化物的碱性比氢氧化铝强,因为铊的金属性比铝强。答案:(1)银白色 (2)低 (3)铊的最高价氧化物对应水化物的碱性比氢氧化铝强,因为铊的金属性比铝强。关键能力·合作学习 知识点 元素周期表的应用 1.元素“位”“构”“性”之间的关系图难点突破2.元素的原子结构与元素在周期表中的位置关系3.原子结构与元素性质的关系4.元素性质与元素在周期表中位置的关系【合作探究】1.(思维升华)如果已知X、Y为周期表中相邻的两元素,且它们的最高价氧化物对应水化物的酸性强弱为X>Y,能否确定它们的相对位置?(宏观辨识与微观探析)提示:可根据元素非金属性的变化规律确定它们的相对位置。由已知条件可确定非金属性为X>Y,所以,如果它们同周期,则X在Y的右面;如果它们同主族,则X在Y的上面。2.(情境应用)把雄黄酒洒在墙角、床底等处,可以驱虫,清洁环境。雄黄是一种矿物质,俗称“鸡冠石”,其主要成分是硫化砷,As位于元素周期表第ⅤA族,另外第ⅥA族元素Se在生活中有广泛应用。砷元素的最高价态是几价?试比较As、Se的氢化物哪个热稳定性强。(科学探究与创新意识)提示:+5价;H2Se。【典例示范】【典例】短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是 ( )A.X的简单氢化物的热稳定性比W的强B.Y的简单离子与X的具有相同的电子层结构C.Z与X的最高正价相同D.Z与X属于同一主族,与Y属于同一周期【解题指南】解答本题需注意以下两点:(1)元素金属性、非金属性的判断依据;(2)同周期的元素性质的递变。【解析】选C。原子半径是所有短周期主族元素中最大的,Y为Na,由“W的简单氢化物可用作制冷剂”知W为N,“由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生”可知该盐为Na2S2O3,则X为O,Z为S。X的简单氢化物为H2O,W的简单氢化物为NH3,H2O的热稳定性比NH3强,A正确;Y的简单离子为Na+,X的简单离子为O2-,Na+与O2-电子层结构相同,B正确;氧元素没有最高正价,C错误;S与O属于同一主族,S与Na属于同一周期,D正确。【规律方法】1.主族元素性质的特殊性:2.熟记元素周期表中金属性、非金属性的递变规律:解答元素推断的题时,可以按元素周期表的位置写出常考元素,标出金属性、非金属性的相对强弱,做题时可快速做出判断。如图:【母题追问】(1)元素W3-、X2-与Y+的半径由大到小的顺序是________________________。 提示:N3-、O2-、Na+。电子层数相同,核电荷数越大半径越小。(2)题干四种元素中,有一种元素的最高价氧化物对应的水化物与该元素的氢化物可以形成一种盐,其化学式为____________。 提示:NH4NO3。元素W是氮元素,最高价氧化物的水化物是硝酸,氢化物是氨气,二者反应生成的是硝酸铵,是一种盐。【素养训练】奥地利首都维也纳一家矿场监督牟勒是第一个提取出碲的人。1782年牟勒从一种被当地人称为“奇异金”的矿石中提取出碲。Te与O、S同主族。(1)碲单质是什么状态的物质?说明理由。提示:固态。同主族非金属单质的熔点逐渐升高,硫单质是固体,故碲单质也是固体。(2)碲的常见化合价有哪些?提示:-2、+4、+6。(3)碲单质有可能是半导体吗?并说明理由。提示:可能是半导体。碲位于分界线附近,具有一定的金属性和非金属性。【补偿训练】制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷的目的。人们曾采用乙醚、NH3、CH3Cl等作制冷剂,但它们不是有毒就是易燃,于是科学家根据元素性质的递变规律开发出了新的制冷剂。根据已有知识,某些元素化合物的易燃性、毒性变化趋势如下:(1)氢化物的易燃性探究:若易燃性:SiH4>PH3>H2S>HCl,请分析CH4、NH3、H2O、HF的易燃性。提示:CH4>NH3>H2O>HF。Si、P、S、Cl位于同周期,氢化物易燃性从左到右逐渐减弱,故C、N、O、F的氢化物易燃性逐渐减弱。(2)化合物的毒性探究:若毒性:PH3>NH3,CCl4>CF4,请预测H2S与H2O、CS2与CO2的毒性强弱。提示:H2S>H2O、CS2>CO2。N与P、F与Cl同主族,结合毒性:PH3>NH3,CCl4>CF4,可知同主族元素形成的结构相似的化合物毒性从上到下增强,故毒性:H2S>H2O、CS2>CO2。(3)科学家发现结构类似的物质的沸点与相对分子质量的大小有关。已知CCl4的沸点为76.8 ℃,CF4的沸点为-128 ℃,新的制冷剂的沸点范围应介于二者之间,经过较长时间的反复实验,发现了制冷剂CF2Cl2(氟利昂),然而这种制冷剂造成了当今的环境问题。这个环境问题是什么?提示:大气臭氧层出现空洞。(4)在制冷剂的发现中虽然造成了环境问题,但求助于周期表中元素及其化合物的性质变化趋势开发制冷剂的科学思维方法是值得借鉴的。在上述探究中主要分析了物质的哪些性质变化规律?提示:易燃性、毒性、沸点。【课堂小结】三言两语话重点 1.必记周期表的三个应用(1)在周期表中金属与非金属分界处,可以找到半导体材料。(2)在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料。(3)在元素周期表的氟、氯、硫、磷附近,寻找制备农药的元素。2.“位”“构”“性”之间的关系课堂检测·素养达标1.(双选)根据元素周期律和元素周期表,下列推断不合理的是 ( )A.第35号元素的单质在常温常压下是液体B.位于第四周期第ⅤA族的元素为金属元素C.第84号元素的最高化合价是+7D.第七周期0族元素的原子序数为118课堂达标【解析】选B、C。35号元素是溴元素,单质Br2在常温常压下是红棕色的液体,A合理;第四周期第ⅤA族的元素是砷元素(As),为非金属元素,B不合理;第84号元素位于第六周期ⅥA族,为钋元素(Po),由于最高正价等于主族序数,所以该元素最高化合价是+6,C不合理;第七周期0族元素是第七周期最后一个元素,原子序数为118,D合理。2.(双选)(教材二次开发·教材习题改编)短周期主族元素A、B、C、D、E的原子序数依次增加,A和D的质子数之和等于E的核外电子数,B和D同主族,C的原子半径是短周期主族元素中最大的,A和E组成的化合物AE是常见强酸。下列说法错误的是 ( )A.简单离子半径:B>CB.热稳定性:A2D>AEC.C、B两元素可以形成1∶1的化合物D.DB2和化合物AEB,都具有漂白性,二者漂白原理相同【解析】选B、D。短周期主族元素中原子半径最大的C是钠(Na);化合物AE是常见强酸,结合原子序数递增,可知A为氢(H)、E为氯(Cl);又A和D的质子数之和等于E的核外电子数,则D为硫(S);因B和D同主族,则B为氧(O)。简单离子半径:B>C,A正确;热稳定性:H2SHCl>PH3C.原子半径:S>F>OD.酸性:HClO>HNO3>H2CO3【解析】选B。因金属性:Na>Mg>Al,碱性:NaOH>Mg(OH)2>Al(OH)3,A错误;非金属性:F>Cl>P,氢化物稳定性:HF>HCl>PH3,B正确;同周期主族元素随原子序数递增,原子半径逐渐减小,因此原子半径:O>F,C错误;酸性HNO3>H2CO3>HClO,D错误。3.短周期中三种元素a、b、c在周期表中的位置如图,下列有关这三种元素的叙述正确的是 ( )A.a是一种活泼的非金属元素B.c的最高价氧化物的水化物是一种强酸C.b的氢化物不稳定D.b元素的最高化合价为+7价【解析】选B。根据周期表可判断出a、b、c分别为He、F、S。He是稀有气体,化学性质稳定,A错误;c的最高价氧化物的水化物是H2SO4,H2SO4是强酸,B正确;b的氢化物为HF,HF很稳定,C错误;F无正价,D错误。【补偿训练】1.镁、锂在元素周期表中具有特殊的“对角线”位置关系,它们性质相似,例如它们的单质在过量氧气中燃烧均只生成正常氧化物。以下对锂的性质叙述正确的是 ( )A.Li2SO4难溶于水B.LiOH是易溶于水,受热不分解的强碱C.Li不能从水中置换出H2D.Li2CO3受热分解,生成Li2O和CO2【解析】选D。根据处于“对角线”位置关系上的元素,它们的性质相似。MgSO4易溶于水,因此Li2SO4也溶于水,A错误;Mg(OH)2是难溶于水,受热易分解的中强碱,所以LiOH也是难溶于水,受热易分解的中强碱,B错误;Mg能与水反应置换出H2,所以Li同样也能,C错误;MgCO3受热易分解生成MgO和CO2,因此Li2CO3受热也易分解,生成Li2O和CO2,D正确。2.(2019·寿光高一检测)近年来,我国在超导研究方面居世界领先地位,铊(Tl)是超导体的组成成分之一,铊位于第六周期ⅢA族。 下列对铊的性质推导可能正确的是 ( )①铊是易导电的银白色金属 ②Tl(OH)3是两性氢氧化物 ③Tl3+的氧化能力比Al3+的强 ④单质能跟稀HNO3反应生成硝酸盐A.①④ B.②③ C.只有① D.只有④【解析】选A。铊位于第六周期ⅢA族,与Al同族,同主族元素,随着原子序数增大,元素原子失电子能力逐渐增强,金属离子的氧化性逐渐减弱,最高价氧化物对应水化物的碱性逐渐增强。故①④正确。4.(2020·丽水高一检测)在“世界硒都”——恩施,硒资源相对丰富和集中,属于高硒区,该地盛产富硒茶,含有人体所必需的硒元素,有一定的保健作用。已知硒元素与氧元素同族,与钙元素同周期。下列关于硒的描述不正确的是( )A.原子序数为24B.最高价氧化物是SeO3,是酸性氧化物C.原子半径比钙小D.气态氢化物的化学式是H2Se,稳定性比HCl差【解析】选A。根据题意可知该元素在第4周期ⅥA族,原子序数为16+18=34,A项错误;最高价氧化物化学式为SeO3,是酸性氧化物,B项正确;同周期从左到右,原子半径依次减小,C项正确;氢化物稳定性:HCl>H2S>H2Se,D项正确。【素养新思维】5.我国著名化学家张青莲精确地测定了锗(Ge)、锌等九种元素的相对原子质量,得到的新值被作为国际新标准。已知锗的原子序数为32。回答下列问题:(1)它位于元素周期表中第______周期______族。 (2)锗类似于铝,能溶于氢氧化钠溶液,其主要原因是________(填编号)。 ①它与硅位于同一主族②它与铝属于同一周期③它位于周期表中金属与非金属分界线附近(3)材料科学是目前全世界研究的热点,为了寻找催化剂,科学家应在元素周期表中某区域寻找元素组成材料,该区域是________。 A.左上角 B.右上角C.过渡元素 D.金属与非金属分界线附近(4)氢化物的稳定性GeH4______CH4(填“>”或“<”),锗酸(H4GeO4)是______(填“难”或“易”)溶于水的________(填“强”或“弱”)酸。 【解析】(1)根据元素周期表的结构可知,锗属于第四周期第ⅣA族元素。(2)锗位于元素周期表中金属与非金属分界线附近,它具有某些金属元素的性质,又具有某些非金属元素的性质,它是金属元素。(3)在过渡元素中寻找催化剂。(4)氢化物的稳定性:GeH4H4SiO4>H4GeO4,故H4GeO4为难溶于水的弱酸。答案:(1)四 ⅣA (2) ③ (3)C (4)< 难 弱【补偿训练】 下表为元素周期表的一部分。回答下列问题:(1)Z元素在周期表中的位置为______________。 (2)表中元素原子半径最大的是(写元素符号)________________。 (3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是____________________。 a.Y单质与H2S溶液反应,溶液变浑浊b.在氧化还原反应中,1 molY单质比1 mol S得电子多c.Y和S两元素的简单氢化物受热分解,前者的分解温度高【解析】从图中的C、N、S的位置,可以推出X是硅元素,Y是氧元素,Z是氯元素。(1)Z是氯元素,在元素周期表第3周期ⅦA族。(2)表中元素原子半径最大的是Si。(3)a.氧气能与H2S反应置换出硫单质,说明氧气的氧化性大于硫,从而说明氧的非金属性大于硫。b.在氧化还原反应中得电子多少与氧化性、非金属性强弱无关。c.元素非金属性越强,其氢化物越稳定。答案:(1)第3周期ⅦA族 (2)Si (3)a、c本节内容结束
第4课时 元素周期表的应用专题5 微观结构与物质的多样性第一单元 元素周期律和元素周期表学习目标1.了解元素周期表与元素周期律的应用。2.体会元素周期表在学习元素及其化合物知识及科学研究中的重要作用。元素周期表的应用1.元素金属性与非金属性递变规律(1)同周期(从左到右),核电荷数逐渐增大,原子半径逐渐_____,失电子能力减弱,得电子能力增强,____________________________。(2)同主族(自上而下),核电荷数逐渐增大,原子半径逐渐_____,失电子能力增强,得电子能力减弱,____________________________。(3)元素周期表中左下方是金属性最强的元素___,右上方是非金属性最强的元素___。碱性最强的是_____,酸性最强的含氧酸是_____。必备知识·自主学习减小元素金属性减弱,非金属性增强增大元素金属性增强,非金属性减弱铯氟CsOHHClO4知识梳理2.金属元素与非金属元素的分区(1)分界线的划分请填写出图中序号所表示的内容:①_____ ②_____ ③_____ ④_____ ⑤___ ⑥___⑦_____ ⑧_______(2)分界线附近元素的性质:既能表现出一定的_______,又能表现出一定的__________。增强增强增强增强AlSi金属非金属金属性非金属性3.元素周期律和元素周期表的应用(1)根据元素在周期表中的位置推测其_________和_____。(2)根据元素的_________推测它在周期表中的位置。(3)指导新元素的发现及预测它们的_______________。(4)指导其他与化学相关的科学技术。①在周期表中___________________,可以找到半导体材料。②在_________中寻找催化剂和耐高温、耐腐蚀的合金材料。③在元素周期表的___________________,寻找制备农药的元素。原子结构性质原子结构原子结构和性质金属与非金属分界处过渡元素氟、氯、硫、磷附近【自主探索】铊位于第六周期第ⅢA族,铊元素在研究光导纤维、催化剂和超导材料等方面具有重要作用。在第二次世界大战期间,氯化铊的混合晶体就曾被用来传送紫外线,深夜进行侦察敌情或自我内部联络。元素铊的相关信息如图所示。根据卡片信息回答下列问题:请预测:(1)铊单质的颜色可能是:________。 (2)铊单质的熔点比Al________。 (3)铊的最高价氧化物对应水化物的碱性比氢氧化铝强还是弱?请说明理由。【解析】(1)铝单质是银白色的,故铊的颜色可能是银白色。(2)同主族金属单质的熔点从上到下逐渐降低,故铊单质的熔点比Al低。(3)铊的最高价氧化物对应水化物的碱性比氢氧化铝强,因为铊的金属性比铝强。答案:(1)银白色 (2)低 (3)铊的最高价氧化物对应水化物的碱性比氢氧化铝强,因为铊的金属性比铝强。关键能力·合作学习 知识点 元素周期表的应用 1.元素“位”“构”“性”之间的关系图难点突破2.元素的原子结构与元素在周期表中的位置关系3.原子结构与元素性质的关系4.元素性质与元素在周期表中位置的关系【合作探究】1.(思维升华)如果已知X、Y为周期表中相邻的两元素,且它们的最高价氧化物对应水化物的酸性强弱为X>Y,能否确定它们的相对位置?(宏观辨识与微观探析)提示:可根据元素非金属性的变化规律确定它们的相对位置。由已知条件可确定非金属性为X>Y,所以,如果它们同周期,则X在Y的右面;如果它们同主族,则X在Y的上面。2.(情境应用)把雄黄酒洒在墙角、床底等处,可以驱虫,清洁环境。雄黄是一种矿物质,俗称“鸡冠石”,其主要成分是硫化砷,As位于元素周期表第ⅤA族,另外第ⅥA族元素Se在生活中有广泛应用。砷元素的最高价态是几价?试比较As、Se的氢化物哪个热稳定性强。(科学探究与创新意识)提示:+5价;H2Se。【典例示范】【典例】短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是 ( )A.X的简单氢化物的热稳定性比W的强B.Y的简单离子与X的具有相同的电子层结构C.Z与X的最高正价相同D.Z与X属于同一主族,与Y属于同一周期【解题指南】解答本题需注意以下两点:(1)元素金属性、非金属性的判断依据;(2)同周期的元素性质的递变。【解析】选C。原子半径是所有短周期主族元素中最大的,Y为Na,由“W的简单氢化物可用作制冷剂”知W为N,“由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生”可知该盐为Na2S2O3,则X为O,Z为S。X的简单氢化物为H2O,W的简单氢化物为NH3,H2O的热稳定性比NH3强,A正确;Y的简单离子为Na+,X的简单离子为O2-,Na+与O2-电子层结构相同,B正确;氧元素没有最高正价,C错误;S与O属于同一主族,S与Na属于同一周期,D正确。【规律方法】1.主族元素性质的特殊性:2.熟记元素周期表中金属性、非金属性的递变规律:解答元素推断的题时,可以按元素周期表的位置写出常考元素,标出金属性、非金属性的相对强弱,做题时可快速做出判断。如图:【母题追问】(1)元素W3-、X2-与Y+的半径由大到小的顺序是________________________。 提示:N3-、O2-、Na+。电子层数相同,核电荷数越大半径越小。(2)题干四种元素中,有一种元素的最高价氧化物对应的水化物与该元素的氢化物可以形成一种盐,其化学式为____________。 提示:NH4NO3。元素W是氮元素,最高价氧化物的水化物是硝酸,氢化物是氨气,二者反应生成的是硝酸铵,是一种盐。【素养训练】奥地利首都维也纳一家矿场监督牟勒是第一个提取出碲的人。1782年牟勒从一种被当地人称为“奇异金”的矿石中提取出碲。Te与O、S同主族。(1)碲单质是什么状态的物质?说明理由。提示:固态。同主族非金属单质的熔点逐渐升高,硫单质是固体,故碲单质也是固体。(2)碲的常见化合价有哪些?提示:-2、+4、+6。(3)碲单质有可能是半导体吗?并说明理由。提示:可能是半导体。碲位于分界线附近,具有一定的金属性和非金属性。【补偿训练】制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷的目的。人们曾采用乙醚、NH3、CH3Cl等作制冷剂,但它们不是有毒就是易燃,于是科学家根据元素性质的递变规律开发出了新的制冷剂。根据已有知识,某些元素化合物的易燃性、毒性变化趋势如下:(1)氢化物的易燃性探究:若易燃性:SiH4>PH3>H2S>HCl,请分析CH4、NH3、H2O、HF的易燃性。提示:CH4>NH3>H2O>HF。Si、P、S、Cl位于同周期,氢化物易燃性从左到右逐渐减弱,故C、N、O、F的氢化物易燃性逐渐减弱。(2)化合物的毒性探究:若毒性:PH3>NH3,CCl4>CF4,请预测H2S与H2O、CS2与CO2的毒性强弱。提示:H2S>H2O、CS2>CO2。N与P、F与Cl同主族,结合毒性:PH3>NH3,CCl4>CF4,可知同主族元素形成的结构相似的化合物毒性从上到下增强,故毒性:H2S>H2O、CS2>CO2。(3)科学家发现结构类似的物质的沸点与相对分子质量的大小有关。已知CCl4的沸点为76.8 ℃,CF4的沸点为-128 ℃,新的制冷剂的沸点范围应介于二者之间,经过较长时间的反复实验,发现了制冷剂CF2Cl2(氟利昂),然而这种制冷剂造成了当今的环境问题。这个环境问题是什么?提示:大气臭氧层出现空洞。(4)在制冷剂的发现中虽然造成了环境问题,但求助于周期表中元素及其化合物的性质变化趋势开发制冷剂的科学思维方法是值得借鉴的。在上述探究中主要分析了物质的哪些性质变化规律?提示:易燃性、毒性、沸点。【课堂小结】三言两语话重点 1.必记周期表的三个应用(1)在周期表中金属与非金属分界处,可以找到半导体材料。(2)在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料。(3)在元素周期表的氟、氯、硫、磷附近,寻找制备农药的元素。2.“位”“构”“性”之间的关系课堂检测·素养达标1.(双选)根据元素周期律和元素周期表,下列推断不合理的是 ( )A.第35号元素的单质在常温常压下是液体B.位于第四周期第ⅤA族的元素为金属元素C.第84号元素的最高化合价是+7D.第七周期0族元素的原子序数为118课堂达标【解析】选B、C。35号元素是溴元素,单质Br2在常温常压下是红棕色的液体,A合理;第四周期第ⅤA族的元素是砷元素(As),为非金属元素,B不合理;第84号元素位于第六周期ⅥA族,为钋元素(Po),由于最高正价等于主族序数,所以该元素最高化合价是+6,C不合理;第七周期0族元素是第七周期最后一个元素,原子序数为118,D合理。2.(双选)(教材二次开发·教材习题改编)短周期主族元素A、B、C、D、E的原子序数依次增加,A和D的质子数之和等于E的核外电子数,B和D同主族,C的原子半径是短周期主族元素中最大的,A和E组成的化合物AE是常见强酸。下列说法错误的是 ( )A.简单离子半径:B>CB.热稳定性:A2D>AEC.C、B两元素可以形成1∶1的化合物D.DB2和化合物AEB,都具有漂白性,二者漂白原理相同【解析】选B、D。短周期主族元素中原子半径最大的C是钠(Na);化合物AE是常见强酸,结合原子序数递增,可知A为氢(H)、E为氯(Cl);又A和D的质子数之和等于E的核外电子数,则D为硫(S);因B和D同主族,则B为氧(O)。简单离子半径:B>C,A正确;热稳定性:H2S
相关资料
更多









