

高中化学人教版 (2019)选择性必修1第二节 反应热的计算同步测试题
展开1.太阳能的开发与利用是能源领域的一个重要研究方向,由制取C的太阳能工艺如图所示,下列有关说法正确的是(代表阿伏加德罗常数的值)( )
A.分解1 ml转移的电子数为
B.根据盖斯定律,
C.FeO在转化为C的过程中起催化作用
D.该工艺将太阳能转化为电能
2.已知:①,②。下列能表示和反应的热化学方程式的是( )
A.
B.
C.
D.
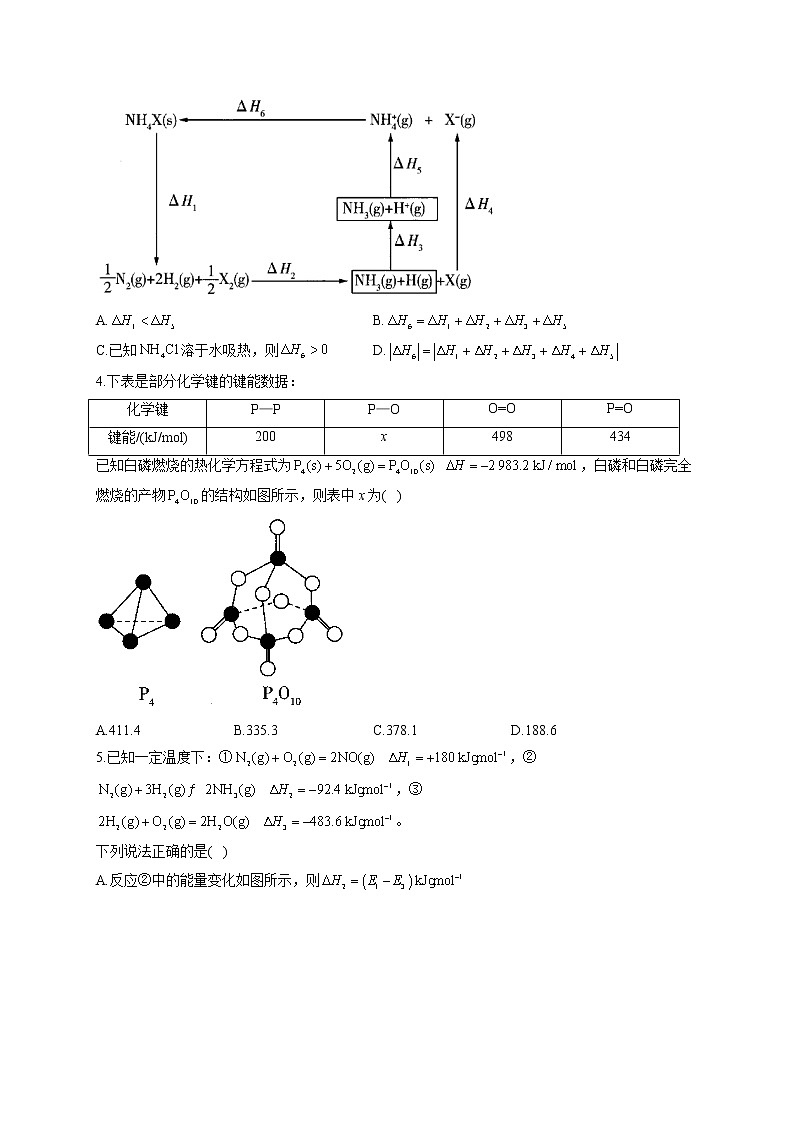
3.(X代表卤素原子)的能量关系如图所示。下列说法正确的是( )
A.B.
C.已知溶于水吸热,则D.
4.下表是部分化学键的键能数据:
已知白磷燃烧的热化学方程式为,白磷和白磷完全燃烧的产物的结构如图所示,则表中x为( )
A.411.4B.335.3C.378.1D.188.6
5.已知一定温度下:①,②,③。
下列说法正确的是( )
A.反应②中的能量变化如图所示,则
B.2 ml完全燃烧生成液态水时放出的热量小于483.6 kJ
C.一定温度下,在一恒容密闭容器中通入1 ml和3 ml,反应后放出的热量为,则
D.氨催化氧化反应的热化学方程式为
6.中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如图所示。
已知:几种物质中化学键的键能如表所示。
若反应过程中分解了2 ml,则下列说法不正确的是( )
A.总反应为B.过程Ⅰ吸收了926 kJ能量
C.过程Ⅱ放出了574 kJ能量D.过程Ⅲ属于放热反应
7.我国利用合成气直接制取烯烃获重大突破,其原理是
反应①:
反应②:
反应③:
反应④:
能量变化如图所示
反应⑤:
下列说法正确的是( )
A.反应③使用催化剂,减小
B.
C.反应④中正反应的活化能(反应物转化为活化分子所吸收的能量)大于逆反应的活化能
D.
二、填空题
8.将煤转化为水煤气的主要化学反应为,、和完全燃烧的热化学方程式分别为:
①
②
③
请回答下列问题。
(1)根据以上数据,写出与水蒸气反应生成水煤气的热化学方程式: 。
(2)比较反应热数据可知和完全燃烧放出的热量之和比完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律得出如下循环图:
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是 (填“甲”或“乙”),理由是 。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点: 。
参考答案
1.答案:A
解析:分解生成FeO和,FeO与反应生成和C,两个反应不互为逆反应,所以,B项错误;在转化为C的过程中Fe元素的化合价升高,则FeO失电子作还原剂,C项错误;该工艺将太阳能转化为化学能,D项错误。
2.答案:A
解析:根据盖斯定律,由②×2–①得。
3.答案:D
解析:一般而言,分解反应为吸热反应,形成化学键需要放热,则,,即,故A项错误;结合盖斯定律可知,,,故B项错误,D项正确;为化学键的形成过程,则,故C项错误。
4.答案:A
解析:1 ml白磷完全燃烧需断开6 ml P—P键、5 ml O=O键,形成12 ml P—O键、4 ml P=O键,所以,解得,A项正确。
5.答案:C
解析:A项,反应热=生成物的总能量–反应物的总能量,因此,错误;B项,,所以2 ml完全燃烧生成液态水时放出的热量大于483.6 kJ,错误;C项,92.4 kJ为生成2 ml氨气时放出的热量,可逆反应不能进行到底,因此,正确;D项,由盖斯定律可知,①×2–②×2+③×3得:,错误。
6.答案:D
解析:由图可知,总反应为水分解生成氯气和氧气,实现了光能向化学能的转化,反应的化学方程式为,故A项正确;过程I为2 ml变成2 ml H原子和2 ml —OH,吸收的总能量为463 kJ×2=926 kJ,故B项正确;过程Ⅱ为2 ml H原子和2 ml —OH生成1 ml和1 ml,放出的总能量为436 kJ+138 kJ=574 kJ,故C项正确;过程Ⅲ为1 ml 变成1 ml和1 ml ,即断开2 ml H—O键和1 ml O—O键,形成1 ml O=O键和1 ml H—H键,吸收的总能量为463 kJ×2+138 kJ=1 064 kJ,放出的总能量为496 kJ+436 kJ=932 kJ,吸收的总能量大于放出的总能量,故过程Ⅲ为吸热反应,故D项错误。
7.答案:B
解析:催化剂不改变反应的焓变,反应③使用催化剂,不变,A错误;根据盖斯定律,①-②得,氢气燃烧放出热量,则,B正确;由题图可知,反应④中正反应的活化能小于逆反应的活化能,C错误;根据盖斯定律可知,可以得到,D错误。
8.答案:(1)
(2)乙;甲同学忽略了煤转化为水煤气要吸收热量(或,且)
(3)减少污染,燃烧充分(合理即可)
解析:根据盖斯定律,由①-②-③即可得,由此可知煤转化为水煤气是吸热反应,而甲正是忽略了这个问题,才误认为“煤转化为水煤气可以使煤燃烧放出更多的热量”。
化学键
P—P
P—O
O=O
P=O
键能/(kJ/ml)
200
x
498
434
化学键
H—O键
O=O键
H—H键
O—O键
键能/(kJ/ml)
463
496
436
138
高中化学人教版 (2019)选择性必修1第二节 反应热的计算综合训练题: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002416_t7/?tag_id=28" target="_blank">第二节 反应热的计算综合训练题</a>,共18页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 反应热的计算课堂检测: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002416_t7/?tag_id=28" target="_blank">第二节 反应热的计算课堂检测</a>,共20页。试卷主要包含了单选题,综合题等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 反应热的计算一课一练: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002416_t7/?tag_id=28" target="_blank">第二节 反应热的计算一课一练</a>,共20页。试卷主要包含了2 反应热的计算 课后训练,8kJ·ml-1、-1411,2kJ·ml-1B.+44,8kJ•ml-1,5Q3﹣Q2+2Q1,4kJ·ml-1,则,2kJ•ml﹣1,,0 kJ·ml-1等内容,欢迎下载使用。













