





人教版 (2019)选择性必修1第二节 反应热的计算优质课课件ppt
展开【思考与交流】请结合以下数据计算H2的燃烧热 ,写出表示H2燃烧热的热化学方程式?
①H2(g)+1/2O2(g)=H2O(g) ΔH1=-241.8kJ/ml②H2O(g)=H2O(l) ΔH2=-44kJ/ml
答案:燃烧热为△H=△H1+△H2= -285.8kJ/ml H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/ml
【思考】所有化学反应的反应热都能直接测出来吗?
在科学研究和工业生产中,常常需要知道反应热的具体数据。许多反应热可以通过实验直接测定,但是有些反应热是无法直接测定的。例如:
C(s) + 1/2O2(g) = CO (g)
该反应的反应热是无法直接测定的。因为 C燃烧时不可能全部生成CO,总有一部分CO2生成。
无法直接测定的反应热应该如何获得呢?能否利用一些已知反应的反应热来计算其他反应的反应热呢?
1836年,俄国化学家盖斯,提出了盖斯定律为我们解决了这个问题。
模块一 盖斯定律的内容
【学习任务一】 盖斯定律的内容
盖斯是俄国化学家,早年从事分析化学研究,1830年专门从事化学热效应测定方法的改进,曾改进拉瓦锡和拉普拉斯的冰量热计,从而较准确地测定了化学反应中的能量。1836年经过多次试验,他总结出一条规律:在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的,1860年以热的加和性守恒定律形式发表。这就是举世闻名的盖斯定律。盖斯定律是断定能量守恒的先驱,也是化学热力学的基础。当一个不能直接发生的反应要求计算反应热时,便可以用分步法测定反应热并加和起来而间接求得。故而我们常称盖斯是热化学的奠基人。
1、盖斯定律: 一个化学反应,不管是一步完成还是分几步完成,其反应热是相同的。化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
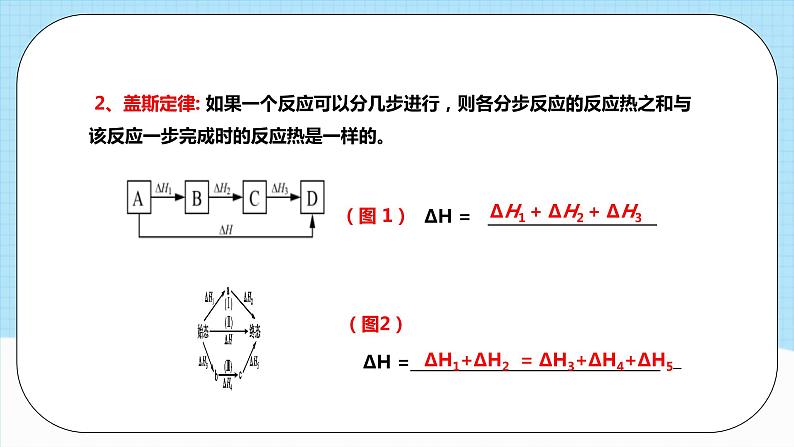
2、盖斯定律: 如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是一样的。
ΔH1 + ΔH2 + ΔH3
ΔH = _____________________
ΔH =_______________________________
ΔH1+ΔH2 = ΔH3+ΔH4+ΔH5_
【典例1】很难直接测得C(s) + 1/2O2(g) = CO (g) 的反应热,但我们可通过盖斯定律获得它的反应热数据。已知①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·ml-1 ②CO(g)+1/2O2(g)=CO2(g) ΔH2=-283.0 kJ·ml-1
应用盖斯定律求解:ΔH1=ΔH+ΔH2 则:ΔH =ΔH1-ΔH2 =-393.5 kJ·ml-1-(-283.0 kJ·ml-1) =-110.5 kJ·ml-1。
【变式1】环戊二烯( )是重要的有机化工原料,广泛用于农药、橡胶等生产。回答下列问题:已知: ① (g)= (g)+H2(g) ΔH1= +100.3 kJ·ml −1 ② H2(g)+ I2(g) =2HI(g)ΔH2= −11.0 kJ·ml −1 对于反应: ③ (g)+ I2(g)= (g)+2HI(g ΔH3=___________kJ·ml −1。
模块二 盖斯定律的意义
二、盖斯定律在生产和科学研究中的意义有些反应,因为某些原因,导致反应热难以直接测定,如:(1)有些反应进行得很慢(2)有些反应不容易直接发生(3)有些反应的产品不纯(有副反应发生)但可以用盖斯定律间接求得。
【学习任务二】 盖斯定律的意义
【典例2】下列关于盖斯定律描述不正确的是( )A.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关B.盖斯定律遵守能量守恒定律C.利用盖斯定律可间接计算通过实验难测定的反应的反应热D.利用盖斯定律可以计算有副反应发生的反应的反应热
模块三 盖斯定律的应用
【典例3】已知:①2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ·ml-1; ②2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·ml-1。则制备水煤气的反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH 为( )A.+262.6 kJ·ml-1 B.-131.3 kJ·ml-1C.-352.3 kJ·ml-1 D.+131.3 kJ·ml-1
【解析】根据盖斯定律,由题意知:①×1/2-②×1/2得:ΔH=(-221.0 kJ·ml-1)×1/2-(-483.6 kJ·ml-1)×1/2=+131.3 kJ·ml-1。
【学习任务三】 盖斯定律的应用
热化学反应方程式加和的方法,目标方程式如何通过“四则运算式”导出?
目标方程式:C(s)+H2O(g)=CO(g)+H2(g),可由已知方程①2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ·ml-1; ②2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·ml-1导出, 运算式为①×1/2-②×1/2
方法总结:写出目标方程式,确定“过渡物质”(要消去的物质),然后用消元法逐一消去“过渡物质”,导出“四则运算式”。
利用盖斯定律求反应热的步骤:
(1)确定要求反应热的待求方程式(目标方程式)。
(2)分析其反应物、生成物在条件方程式中的位置,明确根据已知方程式如何得到目标方程式(加减乘除)。
(3)根据方程式的运算方式得出△H的计算方式 (△H必须带符号进行计算)。
“同边相减,不同边相加”(消元)
【典例4】已知:①CO(g)+1/2O2(g)=CO2(g) ΔH1=-283.0 kJ·ml-1②H2(g)+1/2O2(g)=H2O(l) ΔH2=-285.8 kJ·ml-1③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370 kJ·ml-1试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH
【解析】①×2+②×4-③=④ΔH=ΔH1×2+ΔH2×4-ΔH3 =-283.2 kJ·ml-1×2-285.8 kJ·ml-1×4+1 370 kJ·ml-1 =-339.6 kJ·ml-1
1、(1)已知:①2C(s)+O2(g)=2CO(g) △H1=-221.0 kJ·ml-1 ②2H2(g)+O2(g)=2H2O(g) △H2=-483.6kJ·ml-1 则制备水煤气的反应③C(s)+H2O(g)=CO(g)+H2(g)的△H等于______________________________________________________________________________________________________(2)已知反应: ①H2(g) + O2(g) = H2O(g) ΔH1 ② N2(g) + O2(g) = NO2(g) ΔH2 ③ N2(g) + H2(g) =NH3(g) ΔH3则反应2NH3(g) + O2(g) =2NO2(g) + 3H2O(g)的ΔH=_____________________
+131.3 kJ·ml-1
3ΔH1 + 2ΔH2 - 2ΔH3
根据盖斯定律: (①-②):C(s)+H2O(g)=CO(g)+H2(g) ΔH=131.3kJ∙ml-1
2、近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:(2)Deacn直接氧化法可按下列催化过程进行:CuCl2(s)=CuCl(s)+1/2Cl2(g) ΔH1=+83 kJ·ml− 1CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH2=−20 kJ·ml− 1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=−121 kJ·ml− 1则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH= 。
− 116kJ·ml− 1
3、石墨燃烧过程中的能量变化可用下图表示。下列说法正确的是( )
−136.2 kJ·ml−1
4、NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。用水吸收NOx的相关热化学方程式如下: 2NO2(g)+H2O(l) = HNO3(aq)+HNO2(aq) ΔH= −116.1 kJ·ml−1 3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH= +75.9 kJ·ml−1 求反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH
2、预习下一节内容反应热的计算,并完成导学案
1、完成本节内容盖斯定律的配套练习
高中化学人教版 (2019)选择性必修1第二节 反应热的计算示范课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 反应热的计算示范课课件ppt,共21页。PPT课件主要包含了学习目标,课前导入,知识点一,盖斯定律,①从反应途径分析,②从能量守恒分析,始态S,终态L,盖斯定律的应用,1虚拟路径法等内容,欢迎下载使用。
人教版 (2019)第二节 反应热的计算优质课ppt课件: 这是一份人教版 (2019)第二节 反应热的计算优质课ppt课件,文件包含121盖斯定律练习解析版docx、121盖斯定律练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
高中化学第二节 反应热的计算一等奖ppt课件: 这是一份高中化学第二节 反应热的计算一等奖ppt课件,文件包含人教版高中化学选择性必修一121《盖斯定律》课件pptx、人教版高中化学选择性必修一121《盖斯定律》学案docx等2份课件配套教学资源,其中PPT共20页, 欢迎下载使用。













