






化学选修4 化学反应原理第一节 弱电解质的电离背景图ppt课件
展开(2)水的电离是可逆的,存在电离平衡,它的逆反应为中和反应
结论(1)水是极弱的电解质,它能微弱“自身”电离生成H+与OH-
A、水的电离过程是吸热,升高温度, Kw将增大
25℃时,Kw=c(H+)·c(OH-) =1×10-14
B、水的离子积不仅适用纯水,也适用于酸、碱、盐的稀溶液
Kw=c(H+)·c(OH-)
2、水的离子积常数Kw
(1)定义:在一定温度下,水中c(H+)和c(OH-)的乘积是一个常数,用Kw表示 ,叫做水的离子积常数。
A、酸、碱:温度不变,在纯水中加入酸或碱,均使水的电离左移 , Kw不变 ,α(H2O) 变小
C、易水解的盐:现在知道有它就行不必深究
在纯水中加入能水解的盐,不管水解后显什么性,均促进水的电离,但只要温度不变, Kw不变。
如:向水中加入活泼金属依然是由与水反应的离子还是产物的碱性引起?至于氧化物嘛就不要自己难为自己了。
二、溶液的酸碱性与pH值
1、定义:化学上常采用H+的物质的量浓度的负对数来表示溶液的酸碱性。
3、溶液的酸碱性与pH值的关系(常温)
酸性溶液: c(H+)>c(OH—) pH<7中性溶液: c(H+)=c(OH—) pH=7碱性溶液: c(H+)
2、表示方法:pH= - lg c(H+)
想一想:当氢离子浓度大于0.1ml/L时是用浓度表示方便是用PH表示方便?
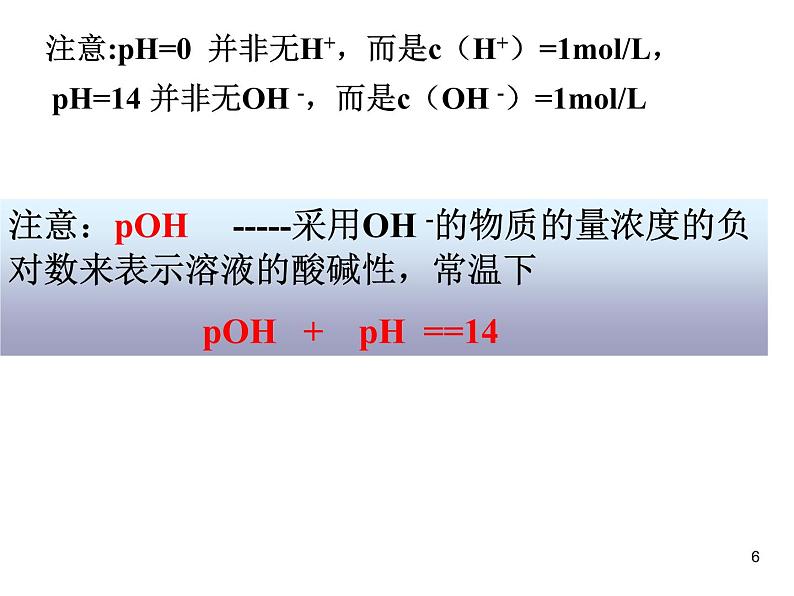
注意:pOH -----采用OH -的物质的量浓度的负对数来表示溶液的酸碱性,常温下 pOH + pH ==14
注意:pH=0 并非无H+,而是c(H+)=1ml/L,
pH=14 并非无OH -,而是c(OH -)=1ml/L
2、强酸、强碱的稀释:
例1、0.001 ml/L盐酸的pH =____,加水稀释到原来的10倍,pH=___,加水到原来的103倍,pH =___,加水到原来的104 倍pH= _____,加水到原来的106倍,pH=______
例2、pH=10的NaOH溶液加水稀释到原来的10倍,则溶液的pH=_____,pH=10的NaOH溶液加水稀释到原来的102倍,则溶液的pH=_______
pH=10的NaOH溶液加水稀释到原来的103倍,则溶液的pH=___,pH=10的NaOH溶液加水稀释到原来的105倍,则溶液的pH=___
注意:pH=6或8时,不可忽略水的电离,只能接近7,酸碱溶液无限稀释,pH只能约等于7或接近7:酸不能大于7;碱不能小于7
结论:强酸(碱)每稀释10倍,pH值向7靠拢一个单位。
3、弱酸、弱碱的稀释例3、pH=3 HAc加水稀释到原来10倍,溶液的pH值范围_________;pH=12 氨水加水稀释到原来10倍,溶液的pH值范围___________。
结论:弱酸(碱)每稀释10倍,pH值向7靠拢不到一个单位;实际是靠近0.5个单位
4、两种pH值不同的同种强酸(碱)溶液等体积混合
例4、pH=10和pH=8的两种NaOH溶液等体积混合,求混合溶液的pH值。是否等同于pH=10 NaOH溶液等体积稀释?
例5、pH=4和pH=5的两种盐酸溶液等体积混合,求混合溶液的pH值
结论: 1、两种强酸溶液等体积混合,溶液的pH值等于浓溶液的pH加0.3。
总结论: 两种强酸(碱)溶液等体积混合,溶液的pH值以原浓溶液的pH向7靠拢0.3个单位。
2、两种强碱溶液等体积混合,溶液的pH值等于浓溶液的pH减0.3。
例8、0.1L pH=2盐酸和0.1L pH=11的NaOH溶液相混合,求混合后溶液的pH值。 例9、pH=2盐酸和pH=12的Ba(OH)2溶液等体积相混合,求混合后溶液的pH值。
5、强酸、强碱溶液的混合,可能涉及过量问题计算
结论:1、pH1+ pH2<14的强酸强碱等体积混合后,pH混= pH酸+0.32、pH1+ pH2=14的强酸强碱等体积混合后,pH混= 73、pH1+ pH2>14的强酸强碱等体积混合后,pH混= pH碱-0.3只有笨蛋才记这些结论,不理解永远不懂!
方法:1、先反应2、按过量的计算,若酸过量,求c(H+),再算pH值。 若碱过量,求c(OH-),求c(H+),再算pH值
五、弱酸强碱或强酸弱碱混合例10、(1)PH为12 的NaOH溶液和PH为2的醋酸溶液等体积相混合,则混合液呈_ ___ _性(2)PH为12 的氨水和PH为2 的盐酸等体积相混合,则混合液呈 ___ _性(3)PH为2 的盐酸和PH为12 的某碱等体积相混合,则混合液PH_______ (4)PH为12 的NaOH溶液和PH为2的某酸溶液等体积相混合,则混合液PH _____(5)盐酸的PH值为X,NaOH溶液的PH为Y,等体积相混合,则混合液PH
己知X+Y=14,它们等体积相混合,混合液的PH值 。己知X+Y<14,它们等体积相混合,混合液的PH值 ____________。己知X+Y>14,它们等体积相混合,混合液的PH值 ____________。
(5)盐酸的PH值为X,NaOH溶液的PH为Y,体积相混合,则混合液PH _____
1、某酸溶液的PH为2 ,某碱溶液的PH为12 ,两者等体积相混合后,有关PH值的变化正确的是( ) A、大于7 B、小于7 C、等于7 D、三种都有可能
2、常温下一种PH为2 的酸溶液与一种PH为12 的碱溶液等体积相混合,对溶液的酸碱性的说法正确的是( ) A、 若是二元强酸和一元强碱,混合液为酸性 B、 若是浓的强酸和稀的强碱,混合液中呈酸性 C、 若是浓的弱酸和稀的强碱,混合液呈碱性 D、若是强酸和强碱相混合,溶液反应后呈中性
3、同体积的PH为3 的盐酸、硫酸、醋酸和硝酸四种溶液,分别加入足量的锌粉,叙述正确的是( ) A、 硫酸溶液中放出的氢气的量最多 B、 醋酸溶液中放出的氢气的量最多 C、 盐酸和硝酸中放出的氢气的量相等 D、盐酸比硝酸放出的氢气的量多
4、向体积均是1L,PH值也相等的盐酸和醋酸两溶液中加入表面积质量均相等的锌块,下列叙述可能正确的是( ) A、 反应开始时,盐酸的速率比醋酸快 B、 反应过程中,醋酸的速率比盐酸快 C、 充分反应后,两者产生的氢气的体积可能相等 D、充分反应后,若有一种溶液中的锌有多余,则一定是盐酸的锌有余
5、酸HA、HB两溶液的PH值为3,且体积相同,加水稀释两溶液,PH值与加入水的体积关系如图所示,则两者酸性较强的是( )
6、酸HA、HB、HC三溶液的物质的量浓度相同,体积也相同,测得它们的PH值分别为2、2.7、3,分别与足量的锌反应,产生的氢气的物质的量 ,初始时,三者的反应速率 ,反应过程中的平均速率 ; 若三种酸的体积与PH值均相等时,分别加入足量的表面积和质量均相等的锌,初始时,三者的反应速率 ,反应过程中的平均速率_________;充分反应后,产生的氢气的物质的量的大小关系 ________,
人教版 (2019)选择性必修1第二节 水的电离和溶液的pH背景图ppt课件: 这是一份人教版 (2019)选择性必修1第二节 水的电离和溶液的pH背景图ppt课件,共35页。
化学第二单元 溶液的酸碱性教学演示课件ppt: 这是一份化学第二单元 溶液的酸碱性教学演示课件ppt,共12页。PPT课件主要包含了学习目标,交流讨论,归纳小结,课堂探究,课堂练习等内容,欢迎下载使用。
《pH的相关计算》人教版高二化学选修4PPT课件: 这是一份人教版 (新课标)选修4 化学反应原理本册综合课前预习ppt课件,共25页。PPT课件主要包含了学习目标,总的原则,-lgcH+,-lgnc,稀释10倍,104molL,稀释100倍,105molL,稀释10000倍,强酸或强碱稀释等内容,欢迎下载使用。













