




【教学课件】微专题 氯气的综合实验探究
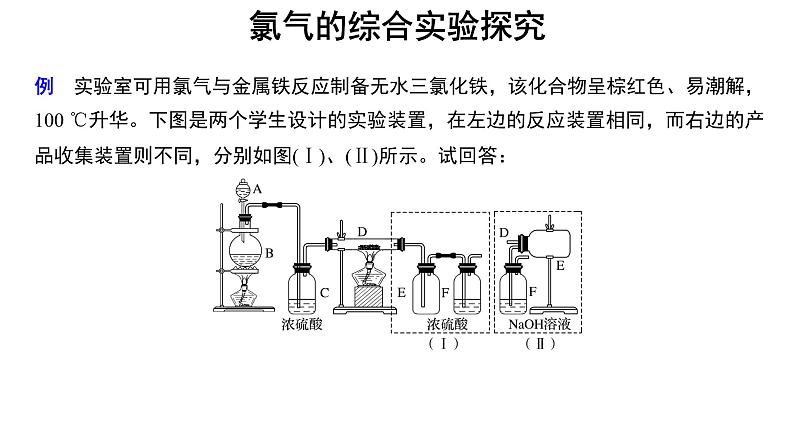
展开例 实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物呈棕红色、易潮解,100 ℃升华。下图是两个学生设计的实验装置,在左边的反应装置相同,而右边的产品收集装置则不同,分别如图(Ⅰ)、(Ⅱ)所示。试回答:
(1)B中反应的化学方程式为_______________________________________。(2)D中的反应在开始前,需排除装置中空气,应采取的方法是____________________________________________________________。
后,看到黄绿色气体充满装置,再开始加热D
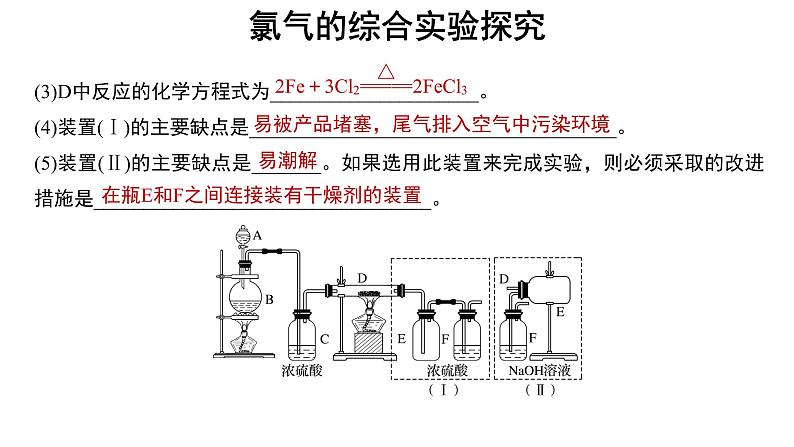
解析 B中制取氯气,在装置C中干燥氯气,氯气和铁在装置D中反应生成气态氯化铁(升华)。若用(Ⅰ)中E瓶收集氯化铁,气态氯化铁被冷却并在导管内壁凝固而堵塞导管,未反应的氯气经F瓶后进入空气中而污染空气。若用(Ⅱ)中E瓶收集氯化铁,能避免(Ⅰ)的弱点,但有水蒸气进入E瓶中使氯化铁发生潮解,因此,要在E瓶和F瓶之间连接装有干燥剂的装置。
(3)D中反应的化学方程式为_____________________。(4)装置(Ⅰ)的主要缺点是_____________________________________。(5)装置(Ⅱ)的主要缺点是_______。如果选用此装置来完成实验,则必须采取的改进措施是__________________________________。
易被产品堵塞,尾气排入空气中污染环境
在瓶E和F之间连接装有干燥剂的装置
解有关制备氯气类题的方法对于有毒、有刺激性气味气体的实验室制取和性质综合实验,应从“反应原理”“发生装置”“净化装置”“干燥装置”“性质检验(或制备物质)”以及“尾气处理”等方面进行分析。(1)反应原理:从反应物来讲,常用KMnO4、KClO3等固体代替MnO2来制取氯气(反应不需要加热)。2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2OKClO3+6HCl(浓)===KCl+3Cl2↑+3H2O(2)净化干燥:题目中若需要干燥纯净的Cl2,则应先除HCl后干燥,饱和食盐水是除去Cl2中混有的HCl气体的最佳试剂。干燥时不能用碱石灰等。
(3)制备物质:若利用Cl2制备其他物质,则根据新制备物质的性质决定Cl2是否除杂干燥,以及防止后边装置中H2O(g)的影响。(4)吸收试剂:从吸收试剂来讲,不能用澄清石灰水来吸收Cl2,原因是Ca(OH)2微溶于水,澄清石灰水中所含的Ca(OH)2的量很少。
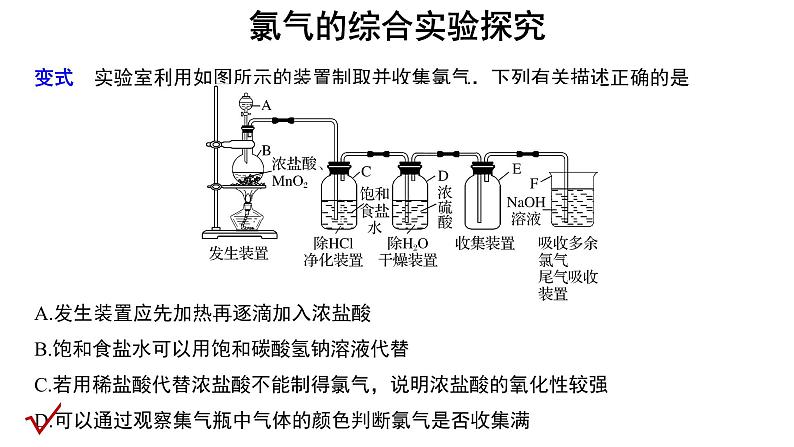
A.发生装置应先加热再逐滴加入浓盐酸B.饱和食盐水可以用饱和碳酸氢钠溶液代替C.若用稀盐酸代替浓盐酸不能制得氯气,说明浓盐酸的氧化性较强D.可以通过观察集气瓶中气体的颜色判断氯气是否收集满
变式 实验室利用如图所示的装置制取并收集氯气,下列有关描述正确的是
解析 浓盐酸易挥发,先加热会加速盐酸的挥发,所以应先加入浓盐酸,再用小火加热,A错误;饱和食盐水的作用是除去氯气中的氯化氢,如果用饱和碳酸氢钠溶液,则碳酸氢钠溶液既吸收氯化氢又吸收氯气,B错误;若用稀盐酸代替浓盐酸不能制得氯气,说明浓盐酸的还原性强,C错误;氯气为黄绿色,可以通过观察集气瓶中气体的颜色判断氯气是否收集满,D正确。
1.实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式:____________________________________________。
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
解析 实验室用浓盐酸与二氧化锰加热反应制备氯气,浓盐酸具有挥发性,制备的氯气中含有氯化氢、水,依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去杂质,依次通过干燥有色布条、湿润有色布条验证氯气是否具有漂白性,再通过G装置验证氯气的氧化性,氯气有毒,能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收尾气。据此分析解答。
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是__________________________________,对比E和F中现象的差异可得出的结论及解释是______________________________。(3)试管C和D中试剂分别为___________________。(4)装置G处发生反应的离子方程式为___________________。(5)用离子方程式表示试剂X的作用:______________________________。
Cl2+2I-===2Cl-+I2
Cl2+2OH-===Cl-+ClO-+H2O
①“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:______________________________。②需“密闭保存”的原因:________________________________________________________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。
注意事项:1.本品对棉织品有漂白脱色作用,对金属制品有腐蚀作用。2.密封保存,请勿与洁厕灵同时作用。3.保质期为一年
Cl-+ClO-+2H+=== Cl2↑+H2O
NaClO溶液与空气中CO2反应生成HClO,HClO不稳定
2.某校化学实验小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,设计了如图所示的实验装置(部分支撑用的铁架台省略)。已知:氯气易溶于四氯化碳,而氯化氢不溶。
按要求回答下列问题:(1)若用含有0.2 ml HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况)总是小于1.12 L的原因是______________________________________________________________。
随着反应的进行,浓盐酸的浓度逐渐减小变为稀盐酸,反
解析 浓盐酸被MnO2氧化生成Cl2,反应一段时间后浓盐酸的浓度变小,变为稀盐酸,反应就会停止。
(2)①装置B中盛放的试剂名称为____________,作用是_________________,现象是___________________________________。②装置D和E中出现的不同现象说明的问题是_____________________________。③装置F的作用是__________。④写出装置G中发生反应的离子方程式:___________________。
白色固体变成蓝色(其他合理答案也可)
氯气无漂白性,次氯酸有漂白性
Ag++Cl-===AgCl↓
2024届高三化学二轮复习 专题十二 综合实验探究 课件: 这是一份2024届高三化学二轮复习 专题十二 综合实验探究 课件,共60页。PPT课件主要包含了球形冷凝管,防暴沸,FeCl2,Fe3+水解,恒压滴液漏斗,排除空气产生的干扰,雷尼Ni堵塞导管,冷凝回流SOCl2,⑥⑩③⑤,CCl4等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 氯及其化合物教学课件ppt: 这是一份人教版 (2019)必修 第一册第二节 氯及其化合物教学课件ppt,共26页。PPT课件主要包含了素养要求,任务1,氯离子的检验,任务2,氯气的实验室制法,限时训练,任务3等内容,欢迎下载使用。
化学必修 第一册第二节 氯及其化合物教学ppt课件: 这是一份化学必修 第一册第二节 氯及其化合物教学ppt课件,共28页。PPT课件主要包含了素养要求,氯气与单质的反应,碱的反应,课堂检测等内容,欢迎下载使用。













