
初中化学人教版九年级下册课题 2 金属的化学性质导学案
展开九年级化学下册 第八单元 课题2 金属的化学性质导学案
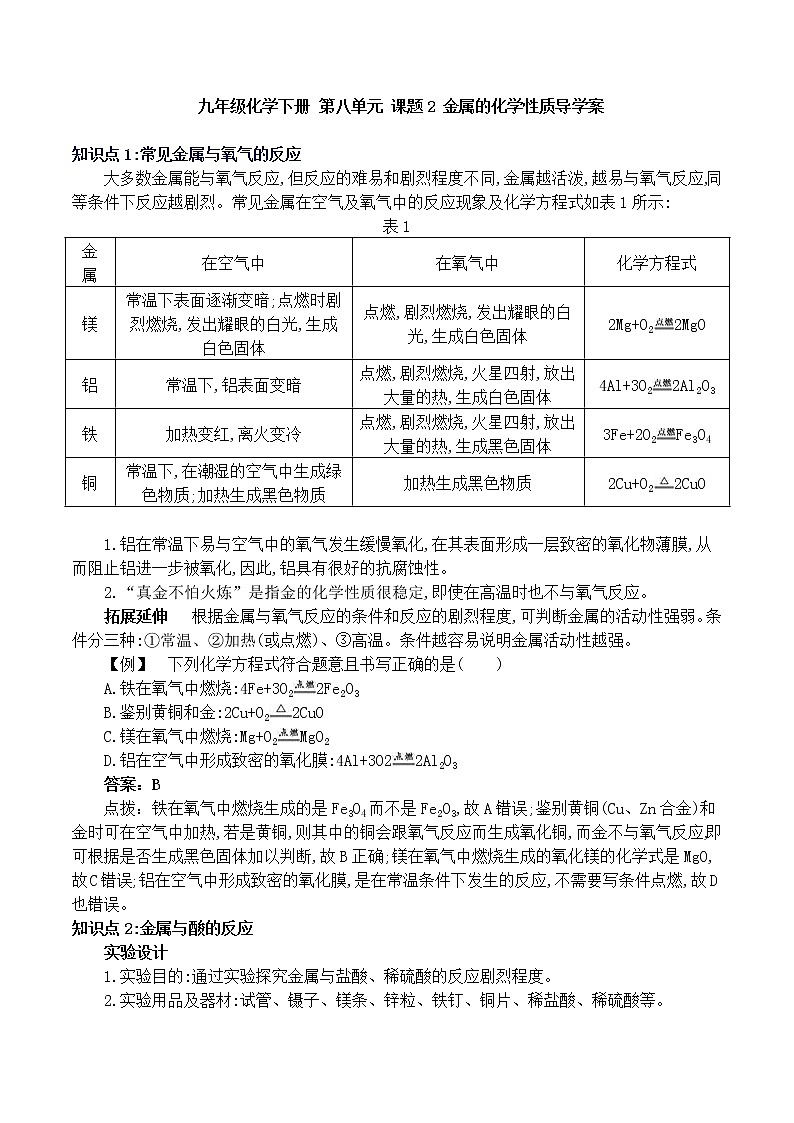
知识点1:常见金属与氧气的反应
大多数金属能与氧气反应,但反应的难易和剧烈程度不同,金属越活泼,越易与氧气反应,同等条件下反应越剧烈。常见金属在空气及氧气中的反应现象及化学方程式如表1所示:
表1
金 属 | 在空气中 | 在氧气中 | 化学方程式 |
镁 | 常温下表面逐渐变暗;点燃时剧烈燃烧,发出耀眼的白光,生成白色固体 | 点燃,剧烈燃烧,发出耀眼的白光,生成白色固体 | 2Mg+O22MgO |
铝 | 常温下,铝表面变暗 | 点燃,剧烈燃烧,火星四射,放出大量的热,生成白色固体 | 4Al+3O22Al2O3 |
铁 | 加热变红,离火变冷 | 点燃,剧烈燃烧,火星四射,放出大量的热,生成黑色固体 | 3Fe+2O2Fe3O4 |
铜 | 常温下,在潮湿的空气中生成绿色物质;加热生成黑色物质 | 加热生成黑色物质 | 2Cu+O22CuO |
1.铝在常温下易与空气中的氧气发生缓慢氧化,在其表面形成一层致密的氧化物薄膜,从而阻止铝进一步被氧化,因此,铝具有很好的抗腐蚀性。
2.“真金不怕火炼”是指金的化学性质很稳定,即使在高温时也不与氧气反应。
拓展延伸 根据金属与氧气反应的条件和反应的剧烈程度,可判断金属的活动性强弱。条件分三种:①常温、②加热(或点燃)、③高温。条件越容易说明金属活动性越强。
【例】 下列化学方程式符合题意且书写正确的是( )
A.铁在氧气中燃烧:4Fe+3O22Fe2O3
B.鉴别黄铜和金:2Cu+O22CuO
C.镁在氧气中燃烧:Mg+O2MgO2
D.铝在空气中形成致密的氧化膜:4Al+3O22Al2O3
答案:B
点拨:铁在氧气中燃烧生成的是Fe3O4而不是Fe2O3,故A错误;鉴别黄铜(Cu、Zn合金)和金时可在空气中加热,若是黄铜,则其中的铜会跟氧气反应而生成氧化铜,而金不与氧气反应,即可根据是否生成黑色固体加以判断,故B正确;镁在氧气中燃烧生成的氧化镁的化学式是MgO,故C错误;铝在空气中形成致密的氧化膜,是在常温条件下发生的反应,不需要写条件点燃,故D也错误。
知识点2:金属与酸的反应
实验设计
1.实验目的:通过实验探究金属与盐酸、稀硫酸的反应剧烈程度。
2.实验用品及器材:试管、镊子、镁条、锌粒、铁钉、铜片、稀盐酸、稀硫酸等。
3.实验步骤:(1)在试管里放入两小块镁,加入5 mL稀盐酸,将燃着的小木条放在试管口,观察现象,并判断反应后生成了什么气体。
(2)参照上述实验步骤,分别向放有两小块锌、铁或铜的试管中加入稀盐酸,观察现象,比较反应的剧烈程度。如果有气体生成,判断生成的是什么气体。
(3)用稀硫酸代替稀盐酸进行上述实验,并比较发生的现象。
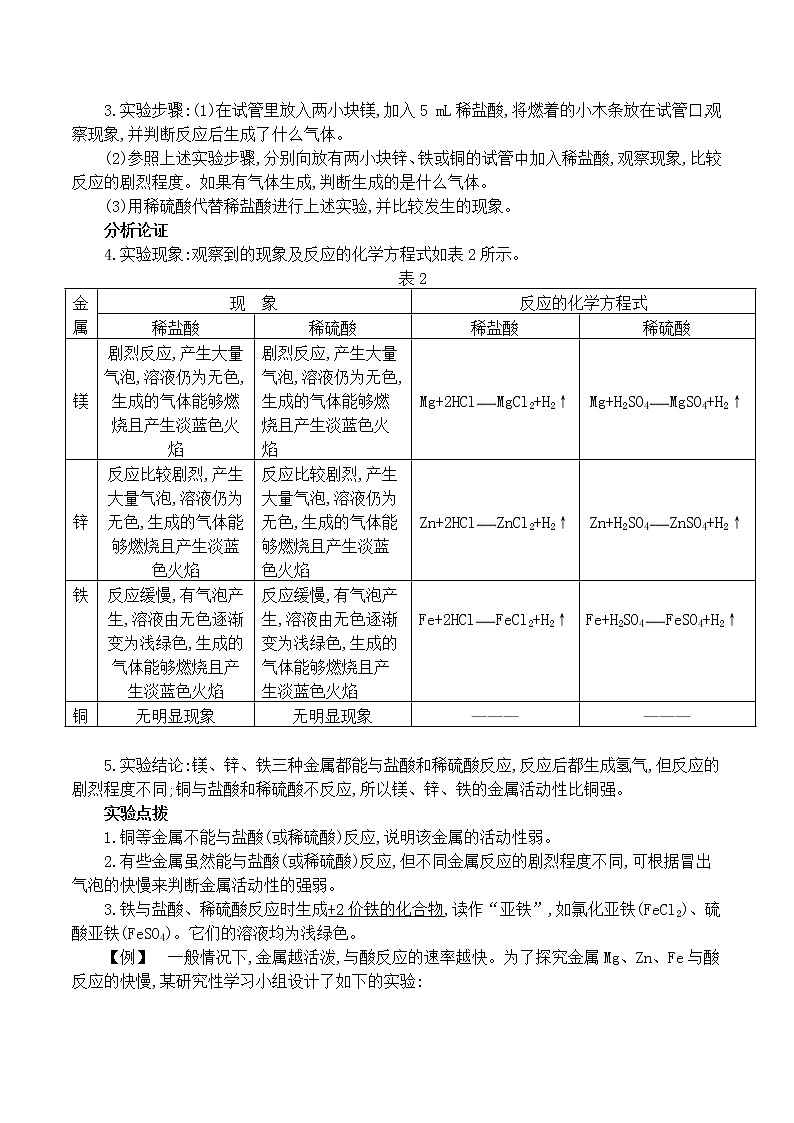
分析论证
4.实验现象:观察到的现象及反应的化学方程式如表2所示。
表2
金属 | 现 象 | 反应的化学方程式 | ||
稀盐酸 | 稀硫酸 | 稀盐酸 | 稀硫酸 | |
镁 | 剧烈反应,产生大量气泡,溶液仍为无色,生成的气体能够燃烧且产生淡蓝色火焰 | 剧烈反应,产生大量气泡,溶液仍为无色,生成的气体能够燃烧且产生淡蓝色火焰 | Mg+2HClMgCl2+H2↑ | Mg+H2SO4MgSO4+H2↑ |
锌 | 反应比较剧烈,产生大量气泡,溶液仍为无色,生成的气体能够燃烧且产生淡蓝色火焰 | 反应比较剧烈,产生大量气泡,溶液仍为无色,生成的气体能够燃烧且产生淡蓝色火焰 | Zn+2HClZnCl2+H2↑ | Zn+H2SO4ZnSO4+H2↑ |
铁 | 反应缓慢,有气泡产生,溶液由无色逐渐变为浅绿色,生成的气体能够燃烧且产生淡蓝色火焰 | 反应缓慢,有气泡产生,溶液由无色逐渐变为浅绿色,生成的气体能够燃烧且产生淡蓝色火焰 |
Fe+2HClFeCl2+H2↑ |
Fe+H2SO4FeSO4+H2↑ |
铜 | 无明显现象 | 无明显现象 | ——— | ——— |
5.实验结论:镁、锌、铁三种金属都能与盐酸和稀硫酸反应,反应后都生成氢气,但反应的剧烈程度不同;铜与盐酸和稀硫酸不反应,所以镁、锌、铁的金属活动性比铜强。
实验点拨
1.铜等金属不能与盐酸(或稀硫酸)反应,说明该金属的活动性弱。
2.有些金属虽然能与盐酸(或稀硫酸)反应,但不同金属反应的剧烈程度不同,可根据冒出气泡的快慢来判断金属活动性的强弱。
3.铁与盐酸、稀硫酸反应时生成+2价铁的化合物,读作“亚铁”,如氯化亚铁(FeCl2)、硫酸亚铁(FeSO4)。它们的溶液均为浅绿色。
【例】 一般情况下,金属越活泼,与酸反应的速率越快。为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验:
【实验步骤】①取A、B、C三支试管,分别加入2 mL质量分数相同的盐酸;②分别加入足量的大小相等的镁、锌、铁块,并立即把三个相同的气球分别套在各试管口上。
【实验预测与分析】(1)写出铁与盐酸反应的化学方程式: 。
(2)气球膨胀速率最快的是 。
(3)该实验表明,实验室一般选用锌而不选用镁、铁制取氢气的主要原因是
。
(4)步骤②是实验获得成功的关键,你认为在操作过程中小组成员之间应该
。
答案:(1)Fe+2HClFeCl2+H2↑ (2)加Mg的试管口的气球 (3)锌与酸反应速率适中,易控制(或镁与酸反应速率太快,不易控制,而铁与酸反应速率太慢) (4)分工合作(或团结协作等)
点拨:(1)铁与盐酸反应生成+2价铁的化合物。(2)由已知条件金属越活泼与酸反应越快,Mg在三种金属中最活泼,因此Mg与酸的反应速率最快,其气球膨胀最快。(3)应从金属与酸反应的快慢角度分析。(4)三个反应同时进行,需实验小组成员之间团结协作,体现了合作探究的学习方法。
知识点3:金属与金属化合物溶液反应
实验设计
1.实验目的:通过实验探究金属与某些金属化合物溶液的反应情况。
2.实验用品及器材:试管、砂纸、铝丝、铜丝、CuSO4溶液、AgNO3溶液、Al2(SO4)3溶液等。
3.实验步骤:(1)把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,过一会儿后取出,观察现象。(2)把一根洁净的铜丝浸入硝酸银溶液中,过一会儿后取出,观察现象。(3)把一根洁净的铜丝浸入硫酸铝溶液中,过一会儿后取出,观察现象。
分析论证
4.实验现象:观察到的现象及发生反应的化学方程式如表3所示。
表3
实验操作 | 现 象 | 反应的化学方程式 |
铝丝浸入硫酸铜溶液中 | 浸入溶液中的铝丝表面覆盖一层紫红色的物质,溶液由蓝色逐渐变为无色 | 2Al+3CuSO4Al2(SO4)3+3Cu |
铜丝浸入硝酸银溶液中 | 浸入溶液中的铜丝表面覆盖一层银白色的物质,溶液由无色逐渐变为蓝色 | Cu+2AgNO3Cu(NO3)2+2Ag |
铜丝浸入硫酸铝溶液中 | 无明显现象 | ——— |
5.实验结论:铝能跟硫酸铜溶液反应,铜能跟硝酸银溶液反应,但铜不能跟硫酸铝溶液反应,说明铝的活动性比铜强,铜的活动性比银强。
实验点拨
1.因铝丝表面覆盖一层致密的氧化物薄膜,所以实验前要用砂纸把氧化膜擦去,否则很难反应。
2.铁与某些金属化合物溶液反应时生成+2价铁的化合物。
3.金属化合物必须是可溶于水的。
【例】 将过量的铁投入硫酸和硫酸铜溶液中,充分反应后过滤,滤纸上留有的物质是( )
A.铁和铜 B.铁 C.铜 D.没有固体
答案:A
点拨:硫酸、硫酸铜都能与铁反应,铁将铜置换出来,所以留有的固体中一定有铜,又由于铁是过量的,反应后有剩余,所以也一定有铁,故选A项。
知识点4:置换反应
1.定义:由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应叫做置换反应。置换反应是化学反应基本类型之一,可表示为A+BCAC+B。
2.置换反应与化合反应、分解反应的比较见表4。
表4
反应类型 | 概 念 | 特 点 | 举 例 | 表示式 |
化合 反应 | 两种或两种以上的物质生成另一种物质的反应 | 多变一 | C+O2CO2 CO2+H2OH2CO3 | A+B+…C |
分解 反应 | 一种物质生成两种或两种以上物质的反应 | 一变多 | 2KMnO4K2MnO4+MnO2+O2↑ CaCO3CaO+CO2↑ | CA+B+… |
置换 反应 | 一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应 | 反应物和生成物都是一种单质和一种化合物 | C+2CuO2Cu+CO2↑ Zn+H2SO4ZnSO4+H2↑ | A+BCAC+B |
易错警示 单纯生成单质和化合物的反应或有单质和化合物参加的反应都不一定是置换反应。如2H2O22H2O+O2↑与CH4+2O2CO2+2H2O都不属于置换反应。
【例】 下列反应中,不属于置换反应的是( )
A.Mg+2HClMgCl2+H2↑ B.CO+CuOCu+CO2
C.C+2CuO2Cu+CO2↑ D.Cu+2AgNO32Ag+Cu(NO3)2
答案:B
点拨:解答本题的关键是理解置换反应的定义。置换反应是指由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。B中虽然生成了一种单质和一种化合物,但反应物却是两种化合物,故B不是置换反应。
知识点5:金属活动性顺序及应用
1.常见金属的活动性顺序(见图1)。
图1
2.金属活动性顺序的应用
(1)在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
(2)在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。如Mg、Al、Zn、Fe等能与盐酸(或稀硫酸)发生反应生成氢气,而Cu、Ag等不能与盐酸(或稀硫酸)发生反应。通常把能与盐酸(或稀硫酸)发生反应的金属称为活泼金属。
(3)在金属活动性顺序里,位于前面的金属能把位于后面的金属从其化合物的溶液里置换出来(K、Ca、Na除外)。
巧记速记 金属活动性顺序可采用“五元素一句”方法进行记忆,即“钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金”。
拓展延伸
1.钾、钙、钠的化学性质相当活泼,能与水发生剧烈的化学反应,生成相应的碱和氢气,因此,不能用钾、钙、钠置换其他金属化合物溶液中的金属。
2.盐酸、稀硫酸能与活泼金属发生置换反应,生成氢气,但浓硫酸、硝酸等具有强氧化性,与金属反应不能生成氢气。
【例】 锡(Sn)是五金之一,它的金属活动性顺序位于铁和铜之间,则下列反应不会发生的是( )
A.Zn+Sn(NO3)2Zn(NO3)2+Sn B.Sn+2HClSnCl2+H2↑
C.Sn+2AgNO3Sn(NO3)2+2Ag D.Sn+MgSO4SnSO4+Mg
答案:D
点拨:解答本题的关键是掌握金属与酸、金属与金属化合物溶液反应的规律。金属活动性顺序为Mg>Zn>Fe>Sn>(H)>Cu>Ag,由于Sn的活动性比Mg的弱,所以Sn不能将Mg从其化合物溶液中置换出来,故D项反应不会发生。
考点1:金属的化学性质与物理性质的综合
【例1】 金、银、铜常用做奖牌,也曾作为货币流通,下列有关三种金属的说法,错误的是( )
A.都为不活泼金属 B.其中银的导电能力最强
C.金属活动性顺序Au>Ag>Cu D.铜片可从硝酸银溶液中置换出银来
答案:C
点拨:由金属活动性顺序可知,金、银、铜三种金属都不活泼,但活动性顺序为Cu>Ag>Au,故A正确,C错误;在金属中导电能力最强的是银,其次是铜和金,故B正确;铜的活动性比银强,因此铜能与硝酸银溶液反应置换出银,故D正确。
考点2:金属活动性及应用
【例2】 将质量相等的A、B、C三种金属,同时分别放入三份浓度相等且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图2所示(A、B、C在生成物中的化合价均为+2)。根据图示所提供的信息,得出的结论正确的是( )
图2
A.放出H2的质量是B>A>C B.金属活动性顺序是B>A>C
C.反应速率最快的是A D.相对原子质量是A>B>C
答案:B
点拨:由图示可知:当三种金属完全反应后,放出H2的质量是A>B>C,故A错误;三种金属反应时,相同时间内产生H2的质量关系为B>A>C ,则可判断三种金属的活动性顺序为B>A>C,故B正确;等质量的三种金属完全反应完,B需要的时间最短,因此反应速率最快的是B,故C错误;A、B、C三种金属在生成物中化合价相同,则等质量的三种金属与足量酸反应时,金属的相对原子质量越小,生成的氢气就越多,由于三种金属得到氢气的质量为A>B>C,则相对原子质量为A<B<C,故D错误。
考点3:化学反应类型
【例3】 钛和钛合金被认为是21世纪的重要金属材料。下面是冶炼金属钛过程中的一个重要反应:4Na+TiCl4Ti+4NaCl,该反应属于( )
A.化合反应 B.分解反应 C.置换反应 D.氧化反应
答案:C
点拨:该反应符合“一种单质和一种化合物反应生成另一种单质和另一种化合物”的特点,属于置换反应, 故选C项。
初中课题 2 金属的化学性质导学案: 这是一份初中课题 2 金属的化学性质导学案,共4页。
人教版九年级下册课题 2 金属的化学性质学案设计: 这是一份人教版九年级下册课题 2 金属的化学性质学案设计,共5页。学案主要包含了学习目标,学习重难点,学习过程,学生实验,学习重、难点,演示实验等内容,欢迎下载使用。
化学九年级下册第八单元 金属和金属材料课题 2 金属的化学性质学案设计: 这是一份化学九年级下册第八单元 金属和金属材料课题 2 金属的化学性质学案设计,共6页。学案主要包含了学习目标,学习重点,学习难点,温故知新,巧思妙记,实验探究等内容,欢迎下载使用。













