






初中化学人教版九年级下册课题 2 金属的化学性质试讲课课件ppt
展开1.金属的化学性质2.置换反应3.金属活动性顺序及应用
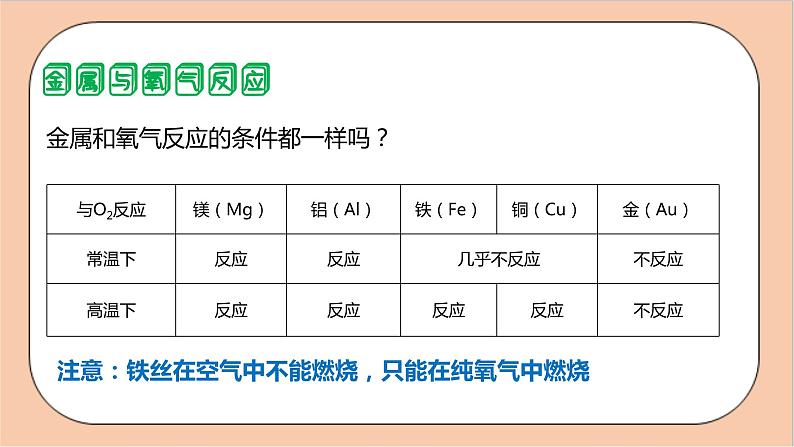
是不是所有金属都能与氧气发生反应?
金属和氧气反应的条件都一样吗?
注意:铁丝在空气中不能燃烧,只能在纯氧气中燃烧
1.镁条在空气中燃烧:2Mg +O2 —— 2MgO 现象:剧烈燃烧,发出耀眼的白光,放热,生成白色固体2.铁丝在氧气中燃烧:3Fe+2O2 —— Fe3O4 现象:剧烈燃烧、火星四射、放出大量的热、生成黑色固体 注意:①做此实验时,瓶底要放少量细沙或水,防止生成的高温的熔化物溅落炸裂瓶底3.氧气通过灼热的铜网:2Cu+ O2 —— 2CuO 现象:红色金属铜变为黑色固体
结论:大多数金属都能与氧气发生化合反应,但反应的难易程度和剧烈程度不相同
说明金属的化学活动性不同,在相同的条件下,金属与氧气反应越容易,金属的活泼性越强,反应越剧烈,金属的活泼性越强。
判断金属活动性的方法一:根据金属与氧气反应的难易程度
金属活动性中铝﹥铁,可是铁比铝更容易生锈。
讨论1:铝的化学性质很活泼,在常温下能与氧气反应,那么我们用的铝制餐具是怎么回事呢?为什么却很耐腐蚀?
讨论1:铝的化学性质很活泼,在常温下能与氧气反应,那么我们用的铝制餐具是怎么回事呢?为什么却很耐腐蚀?铝很容易跟氧气反应,生成一层致密而坚固的氧化铝薄膜,这层薄膜可以阻止内部的铝跟氧气接触,从而对铝制品起到保护作用。
讨论2:为何不宜用钢丝球来擦洗铝制餐具呢?
讨论2:为何不宜用钢丝球来擦洗铝制餐具呢?容易把表面的氧化铝保护膜除掉,从而失去了保护作用。
资料:16世纪中叶,瑞士化学家帕拉塞斯和17世纪的一些化学家,都发现了有些金属和酸可以反应生成一种可燃性气体——氢气.
1.所有的金属都可以和酸反应吗?2.它们和酸反应的剧烈程度一样吗?
1.哪些金属与盐酸反应?哪些不与盐酸反应?2.与酸反应的剧烈程度如何?谁最活泼?
活动性:Mg> Zn > Fe > Cu结论:反应现象越剧烈,就越活泼
实验:镁、锌、铁、铜分别与稀盐酸反应
镁、锌、铁、铜的金属活动性:Mg>Zn>Fe>Cu。
结论:1.大多数金属能与稀盐酸或稀硫酸反应;金属 + 酸 → 含金属的化合物 + H2 ↑2.判断金属活动性的方法二: 可根据金属是否与稀盐酸或稀硫酸反应 或反应的剧烈程度判断金属的活动性强弱
注意:铁在与盐酸、稀硫酸的反应中均生成+2价的亚铁化合物
Mg + 2HCl = MgCl2 + H2↑Zn + 2HCl = ZnCl2 + H2↑Fe + 2HCl = FeCl2 + H2↑Mg + H2SO4 = MgSO4 + H2↑Zn + H2SO4 = ZnSO4 + H2↑Fe + H2SO4 = FeSO4 + H2↑
单质 化合物 化合物 单质
1.概念:由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应叫做置换反应。2.置换反应的特点:A+BC→B+AC注意:置换反应的反应物和生成物中均有单质和化合物,反应前一定有元素化合价的变化
Fe + CuSO4 = Cu + FeSO4
将铁钉投入到硫酸铜溶液中有何现象?现象:铁钉表面会有红色物质析出,则溶液逐渐从蓝色变为浅绿色
铝与硫酸铜溶液的反应
判断金属活动性的方法三:金属能否与金属盐溶液发生反应
金属活动性由强逐渐减弱
1.在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。2.在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。3.在金属活动顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液中置换出来。(k、Ca、Na除外)
人教版九年级下册课题 2 金属的化学性质示范课ppt课件: 这是一份人教版九年级下册课题 2 金属的化学性质示范课ppt课件,共24页。PPT课件主要包含了a比较硬度,b比较密度,一金属与氧气的反应,灼烧法,加入稀硫酸或稀盐酸,FeCu,Al﹥Cu﹥Ag,课本P11探究,置换反应等内容,欢迎下载使用。
初中化学人教版九年级下册课题 2 金属的化学性质课文ppt课件: 这是一份初中化学人教版九年级下册课题 2 金属的化学性质课文ppt课件,共15页。PPT课件主要包含了学习目标,探究活动,活动探究,反应化学方程式,上述反应有什么特点,友情提示等内容,欢迎下载使用。
人教版九年级下册课题 2 金属的化学性质说课ppt课件: 这是一份人教版九年级下册课题 2 金属的化学性质说课ppt课件,共32页。PPT课件主要包含了铝锂合金,镁比铁活泼,小试牛刀,动手操作,金属与氧气的反应,只需打磨少许对比,实验加热铝片,结论一,回忆知识,展示交流等内容,欢迎下载使用。













