

化学必修 第一册第三节 氧化还原反应第一课时学案及答案
展开eq \(\s\up17(),\s\d15(第一章 物质及其变化,第三节 氧化还原反应))
课时作业
第一课时 氧化还原反应
1.下列变化过程一定属于还原反应的是( )
A.HCl→MgCl2 B.Na→Na+
C.CO→CO2 D.Fe3+→Fe2+
答案 D
解析 发生还原反应的过程中某些元素的化合价降低。A项,氯元素的化合价不变;B项,钠元素的化合价升高,属于氧化反应;C项,碳元素的化合价升高,属于氧化反应;D项,铁元素的化合价降低,属于还原反应。
氧化还原反应的判断方法
(1)判断反应是否为氧化还原反应,要抓住两个关键:一是准确判断各反应物、生成物中各元素的化合价及其变化;二是牢记“凡是有元素化合价升降的化学反应都是氧化还原反应”。
(2)氧化反应和还原反应同时发生,有氧化必有还原,化合价有升必有降。
2.下列反应中,画线的物质发生氧化反应的是( )
A.Cu+2FeCl3===2FeCl2+CuCl2
B.CO2+Ceq \(=====,\s\up17(高温))2CO
C.Fe2O3+2Aleq \(=====,\s\up17(高温))Al2O3+2Fe
D.CO2+NaOH===NaHCO3
答案 C
解析 A项,FeCl3中Fe元素化合价降低,FeCl3发生还原反应;B项,CO2中C元素化合价降低,CO2发生还原反应;C项,Al元素化合价升高,Al发生氧化反应;D项不是氧化还原反应。
3.我们生活在千变万化的物质世界里。下列变化中,没有发生氧化还原反应的是( )
答案 C
解析 钢水浇铸是物理变化。
4.下列有关氧化还原反应的叙述不正确的是( )
A.氧化还原反应的本质是电子的转移
B.在氧化还原反应中,失去电子的物质中一定有元素化合价升高
C.在氧化还原反应中肯定有一种元素被氧化,另一种元素被还原
D.在氧化还原反应中不一定所有元素的化合价都发生变化
答案 C
解析 在氧化还原反应中有部分反应,同一种元素既被氧化又被还原,如在反应C+CO2eq \(=====,\s\up17(高温))2CO中,碳元素既被氧化又被还原,故C项不正确。
5.下列反应中,属于氧化还原反应的是( )
①2KMnO4eq \(=====,\s\up17(△))K2MnO4+MnO2+O2↑ ②H2SO4+BaCl2===BaSO4↓+2HCl ③Zn+2HCl===ZnCl2+H2↑ ④Cu2(OH)2CO3eq \(=====,\s\up17(△))2CuO+CO2↑+H2O
A.①② B.②④
C.①③ D.③④
答案 C
解析 ①中Mn、O两种元素的化合价在反应前后发生了变化;③中Zn、H两种元素的化合价在反应前后发生了变化。
6.下列叙述中不正确的是( )
A.复分解反应一定都不属于氧化还原反应
B.在氧化还原反应中,金属单质一定被氧化
C.在氧化还原反应中,非金属单质一定被还原
D.置换反应一定都属于氧化还原反应
答案 C
解析 复分解反应中元素的化合价没有发生变化,一定不是氧化还原反应;置换反应中元素的化合价发生变化,一定是氧化还原反应,A、D正确。氧化还原反应中,金属单质中元素的化合价只能升高,金属单质只能被氧化;而非金属单质中元素的化合价既可能升高,也可能降低,非金属单质既可以被氧化,也可以被还原,B正确,C错误。
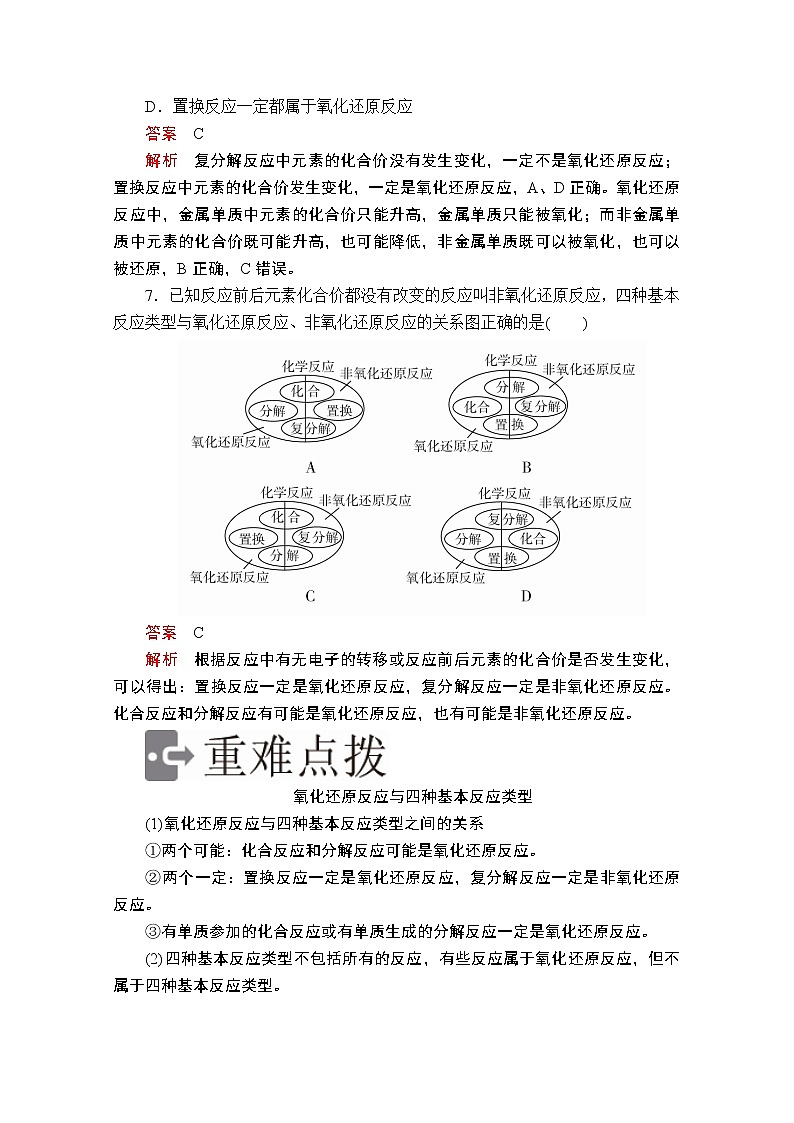
7.已知反应前后元素化合价都没有改变的反应叫非氧化还原反应,四种基本反应类型与氧化还原反应、非氧化还原反应的关系图正确的是( )
答案 C
解析 根据反应中有无电子的转移或反应前后元素的化合价是否发生变化,可以得出:置换反应一定是氧化还原反应,复分解反应一定是非氧化还原反应。化合反应和分解反应有可能是氧化还原反应,也有可能是非氧化还原反应。
氧化还原反应与四种基本反应类型
(1)氧化还原反应与四种基本反应类型之间的关系
①两个可能:化合反应和分解反应可能是氧化还原反应。
②两个一定:置换反应一定是氧化还原反应,复分解反应一定是非氧化还原反应。
③有单质参加的化合反应或有单质生成的分解反应一定是氧化还原反应。
(2)四种基本反应类型不包括所有的反应,有些反应属于氧化还原反应,但不属于四种基本反应类型。
例如:4HCl(浓)+MnO2eq \(=====,\s\up17(△))MnCl2+Cl2↑+2H2O不属于四种基本反应类型中的任何一种反应类型,但属于氧化还原反应。
(3)有单质参加或生成的反应不一定是氧化还原反应。如同素异形体之间的相互转化(如3O2eq \(,\s\up17(放电))2O3)不属于氧化还原反应。
8.化合物X和Y能发生如下化学反应:①X+H2O―→W+H2,②Y+H2O―→N+O2。下列关于反应①②的说法正确的是( )
A.反应①②均属于氧化还原反应
B.反应①属于氧化还原反应,反应②属于非氧化还原反应
C.反应①属于复分解反应,反应②属于氧化还原反应
D.反应①属于氧化还原反应,反应②属于复分解反应
答案 A
解析 反应①②均是由化合物与化合物反应生成单质与另一种物质的反应,则反应中一定有元素化合价发生变化,故反应①②均属于氧化还原反应。
9.下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是( )
A.2Na+2H2O===2NaOH+H2↑
B.CH4+2O2eq \(=====,\s\up17(点燃))CO2+2H2O
C.2KClO3eq \(=====,\s\up17(\a\vs4\al(MnO2)),\s\d15(△))2KCl+3O2↑
D.CaCO3+2HCl===CaCl2+H2O+CO2↑
答案 B
解析 A项是置换反应,不符合题意;B项不属于四种基本反应类型,但属于氧化还原反应,符合题意;C项是分解反应,不符合题意;D项是复分解反应,不符合题意。
10.下列对氧化还原反应分析正确的是( )
答案 C
解析 A项,4HCl→Cl2应失2×e-,错误;B项,Fe→FeCl2应失2e-,被氧化,2HCl→H2应得2×e-,被还原,错误;D项,WO3→W应被还原,3H2→3H2O应被氧化,错误。
氧化还原反应过程中的得失电子守恒
氧化还原反应遵循得失电子守恒,即发生氧化反应的物质失去的电子总数与发生还原反应的物质得到的电子总数相等。同时,化合价升高的总价数与化合价降低的总价数相等。
11.化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,也可分为氧化还原反应和非氧化还原反应。有下列反应:
①CO2+Ceq \(=====,\s\up17(高温))2CO
②Cu2(OH)2CO3eq \(=====,\s\up17(△))2CuO+H2O+CO2↑
③2NaOH+Cl2===NaCl+NaClO+H2O
④2CO+O2eq \(=====,\s\up17(点燃))2CO2
⑤3Fe+4H2O(g)eq \(=====,\s\up17(高温))Fe3O4+4H2
⑥CuO+COeq \(=====,\s\up17(△))Cu+CO2
⑦2H2Oeq \(=====,\s\up17(通电))2H2↑+O2↑
⑧CO2+H2O===H2CO3
(1)其中属于化合反应的有________(填序号,下同),属于置换反应的有________。
(2)在化学反应前后元素的化合价没有变化的是________。
(3)上述反应中,既是分解反应,又是氧化还原反应的是________。
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是________。
(5)根据你的理解,氧化还原反应的实质是________。
A.分子中的原子重新组合
B.氧元素的得失
C.电子的得失或共用电子对的偏移
D.化合价的改变
答案 (1)①④⑧ ⑤ (2)②⑧ (3)⑦ (4)③
(5)C
解析 化学反应的基本类型中,复分解反应一定不是氧化还原反应;置换反应一定是氧化还原反应;化合反应和分解反应,若元素化合价有变化则是氧化还原反应,若元素化合价无变化则是非氧化还原反应。离子反应是否属于氧化还原反应也要根据元素的化合价在反应前后是否发生变化来判断。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应第1课时学案: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应第1课时学案,共12页。
2020-2021学年第三节 氧化还原反应第一课时导学案: 这是一份2020-2021学年第三节 氧化还原反应第一课时导学案,共10页。
高中化学第三节 氧化还原反应第1课时学案设计: 这是一份高中化学第三节 氧化还原反应第1课时学案设计,共15页。学案主要包含了认识氧化还原反应等内容,欢迎下载使用。













