


高中化学人教版 (2019)必修 第一册第二节 元素周期律精品课件ppt
展开知识点一 原子结构的周期性变化
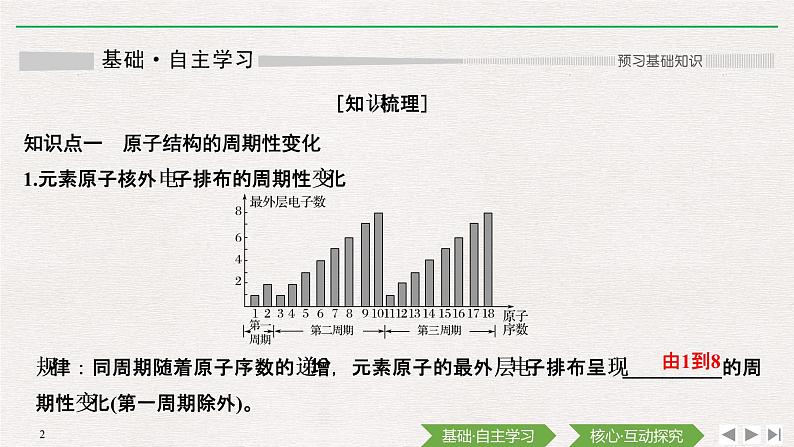
1.元素原子核外电子排布的周期性变化
规律:同周期随着原子序数的递增,元素原子的最外层电子排布呈现__________的周期性变化(第一周期除外)。
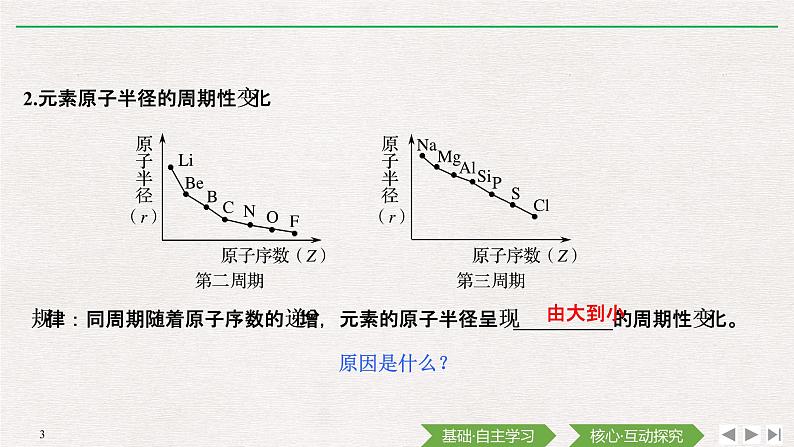
2.元素原子半径的周期性变化
规律:同周期随着原子序数的递增,元素的原子半径呈现__________的周期性变化。
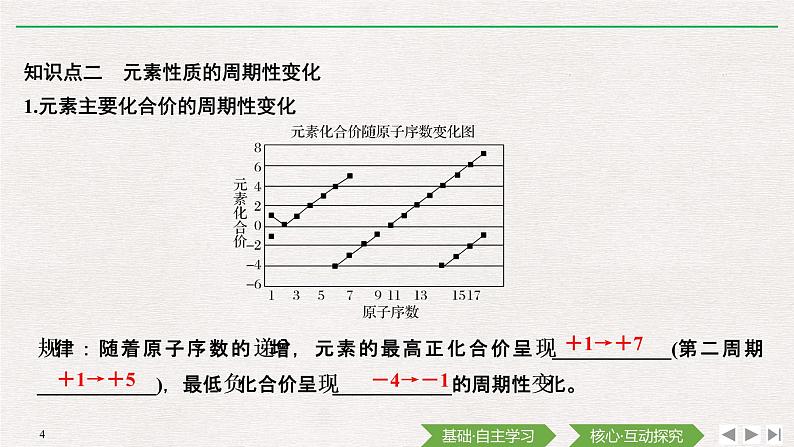
知识点二 元素性质的周期性变化1.元素主要化合价的周期性变化
规律:随着原子序数的递增,元素的最高正化合价呈现____________(第二周期____________),最低负化合价呈现____________的周期性变化。
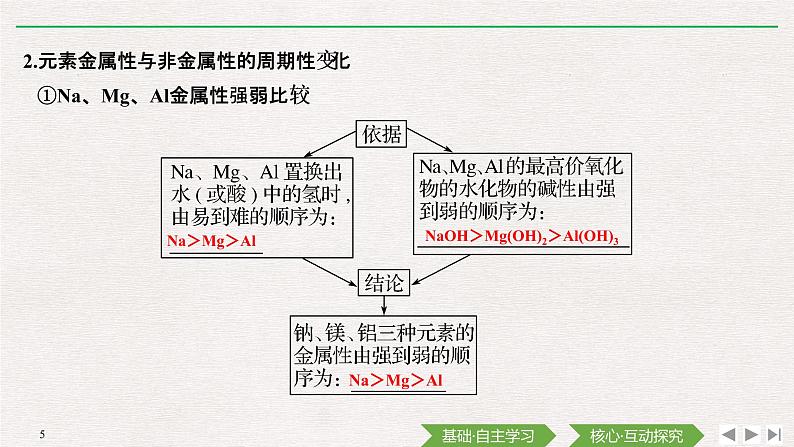
2.元素金属性与非金属性的周期性变化
①Na、Mg、Al金属性强弱比较
NaOH>Mg(OH)2>Al(OH)3
完成下列离子方程式:Al(OH)3+3H+===__________________Al(OH)3+OH-===__________________
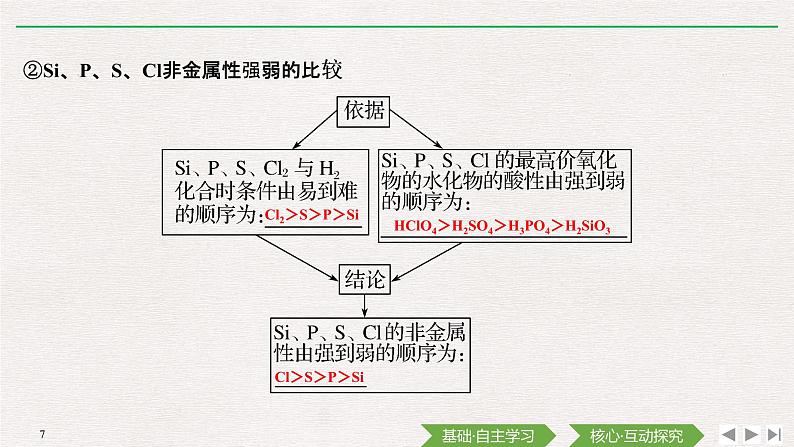
②Si、P、S、Cl非金属性强弱的比较
HClO4>H2SO4>H3PO4>H2SiO3
3.同周期元素性质的递变规律(自左至右)
核电荷数依次_______,原子半径逐渐_______,失电子能力逐渐_______,得电子能力逐渐________。因此金属性逐渐_______,非金属性逐渐_______。
1.内容:元素的性质随着原子序数的递增而呈___________的变化。2.实质:元素性质的周期性变化是_________________呈周期性变化的必然结果。
微判断(1)原子半径:Na>Al。( )(2)离子半径:Na+>Al3+。( )(3)酸性:HCl>H3PO4说明Cl的非金属性比P强。( )(4)Al(OH)3是两性氢氧化物既能和酸反应,又能和强碱反应。( )答案 (1)√ (2)√ (3)× (4)√
微训练1.核电荷数为1~18的元素中,下列说法正确的是( )
A.最外层只有1个电子的元素一定是金属元素B.最外层有2个电子的元素一定是金属元素C.原子核外各层电子数相等的元素一定是金属元素D.最外层电子数为7的原子,最高正价为+7解析 A项中最外层只有1个电子的有H、Li、Na;B项中可以是He、Be、Mg;C项中只能是Be;D项中F无正化合价。答案 C
2.核电荷数为16的元素和核电荷数为4的元素的原子相比较,下列数据前者是后者4倍的是( )
①电子数 ②最外层电子数③电子层数 ④次外层电子数A.①④ B.①③④C.①②④D.①②③④答案 A
3.在第三周期元素中,除稀有气体元素外:
(1)原子半径最小的元素是________(填元素符号)。(2)金属性最强的元素是________(填元素符号)。(3)最高价氧化物对应水化物的酸性最强的是________(用化学式回答,下同)。(4)最不稳定的气态氢化物是________。(5)最高价氧化物对应水化物的碱性最强的是________。(6)氧化物具有两性的是________。答案 (1)Cl (2)Na (3)HClO4 (4)SiH4 (5)NaOH (6)Al2O3
微思考1.如何比较既不同周期也不同主族元素的原子半径大小?以Si、Ca为例说明。
提示 Mg、Si处于同一周期,Mg的核电荷数小于Si的核电荷数,故Mg的原子半径大于Si的原子半径。Mg、Ca处于同一主族,原子半径r(Ca)>r(Mg),故Ca的原子半径大于Si的原子半径,即r(Ca)>r(Si)。
2.如何比较电子层结构相同的微粒的半径大小?以O2-、F-、Na+、Mg2+、Al3+为例说明。
提示 电子层结构相同时,其微粒半径随核电荷数的增加而减小,故离子半径:O2->F->Na+>Mg2+>Al3+。
学习任务1 元素性质的周期性变化规律
1871年,门捷列夫曾预言:在元素周期表中一定存在一种元素,它紧排在锌的后面,处于铝跟铟之间,门捷列夫称之为“类铝”,并预测了它将在酸液和碱液中逐渐溶解,它的氢氧化物必能溶于酸和碱中。
1875年,法国化学家布瓦博德朗在分析闪锌矿时发现了一种新元素,他将新元素命名为镓,并把测得的关于镓的主要性质公布了。不久,他收到了门捷列夫的来信,门捷列夫在信中指出:关于镓的比重不应该是4.7,而是5.9~6.0。当时布瓦博德朗疑惑,他是唯一手里掌握金属镓的人,门捷列夫是怎样知道镓的比重的呢?1876年9月,布瓦博德朗重做了实验,将金属镓提纯重新测定,结果镓的比重确实为5.94(现代值为5.91),这结果使他大为惊奇。门捷列夫为什么能够做到这一点呢?这即是元素周期律的应用,请结合元素周期律完成下列讨论:
1.请从原子结构变化的角度解释,同周期元素随着原子序数的递增,金属性依次减弱、非金属性依次增强的原因。
提示 因同周期元素原子的电子层数相同,但原子序数依次增大,原子半径依次减小,原子核对最外层电子的吸引能力依次增强,失电子能力依次减弱,得电子能力依次增强,故金属性依次减弱,非金属性依次增强。
2.试根据同周期元素非金属性的变化规律,比较SiH4、PH3、H2S和HCl的稳定性。提示 元素的非金属性越强,气态氢化物越稳定。同周期元素,随着原子序数的递增,非金属性逐渐增强,故非金属性:Si<P<S<Cl,所以它们的氢化物的稳定性顺序为SiH4<PH3<H2S<HCl。3.试根据非金属性的强弱,比较H3PO4和HNO3的酸性强弱。提示 P和N均为第ⅤA族元素,随着原子序数的递增,非金属性逐渐减弱,故N的非金属性强于P的非金属性,根据“最高价氧化物对应的水化物酸性越强,非金属性越强”反推可知HNO3的酸性强于H3PO4。
1.原子结构与元素性质的周期性变化
2.同周期、同主族元素原子结构及性质的递变规律
(1)电子层数相同(同周期)时,核电荷数越大,原子核对外层电子的吸引能力越大,原子半径越小,失电子能力减弱,而得电子能力增强,故随核电荷数的递增,金属性逐渐减弱,非金属性逐渐增强。(2)最外层电子数相同(同主族)时,电子层数越多,原子半径越大,原子核对最外层电子的引力越小,越易失电子,元素的金属性越强,非金属性越弱。
【例题】 已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断不正确的是( )
A.气态氢化物的稳定性:HX>H2Y>ZH3B.非金属性:X>Y>ZC.原子半径:X>Y>ZD.原子最外层电子数:X>Y>Z
解析 本题的关键是“最高价氧化物对应水化物的酸性相对强弱”这一信息,由此可推知X、Y、Z为非金属元素,原子序数相连意味着它们属同周期元素,故非金属性:X>Y>Z,原子半径:X<Y<Z,气态氢化物的稳定性顺序为:HX>H2Y>ZH3。答案 C
变式训练 下列有关物质性质的比较不正确的是( )
A.氧化性:Br2>Cl2B.酸性:HClO4>H3PO4C.热稳定性:HCl>HBrD.碱性:NaOH>Mg(OH)2解析 Cl和Br位于第ⅦA族且Cl在Br的上方,因此Cl的非金属性大于Br,因此单质的氧化性Cl2>Br2,气态氢化物的热稳定性HCl>HBr,故A项错误。答案 A
学习任务2 (核心素养)微粒半径大小的比较
一、知识要点粒子半径大小的比较——“四同”规律
(1)同周期——“序大径小”①规律:同周期,从左往右,原子半径逐渐减小。②举例:第三周期中:r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。(2)同主族——“序大径大”①规律:同主族,从上到下,原子(或离子)半径逐渐增大。②举例:碱金属:r(Li)<r(Na)<r(K)<r(Rb)<r(Cs),r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+)。
(3)同元素①同种元素的原子和离子半径比较——“阴大阳小”。某原子与其离子半径比较,其阴离子半径大于该原子半径,阳离子半径小于该原子半径。如:r(Na+)<r(Na);r(Cl-)>r(Cl)。②同种元素不同价态的阳离子半径比较规律——“数大径小”。带电荷数越多,粒子半径越小。如:r(Fe3+)<r(Fe2+)<r(Fe)。
(4)同结构——“序大径小”①规律:电子层结构相同的离子,核电荷数越大,离子半径越小。②举例:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。
所带电荷、电子层均不同的离子可选一种离子参照比较。例:比较r(Mg2+)与r(K+)可选r(Na+)为参照,可知r(K+)>r(Na+)>r(Mg2+)。
【素养解题】[典例示范] 下列各组粒子,按半径由大到小顺序排列正确的是( )
A.Mg、Ca、K、NaB.S2-、Cl-、K+、Na+C.Br-、Br、Cl、SD.Na+、Al3+、Cl-、F-
[微粒半径大小比较题目解题模板]
1.已知下列原子的半径:
根据以上数据,P原子的半径可能是( )×10-10 m×10-10 ×10-10 m×10-10 m解析 根据元素周期律可知,磷原子的半径应在Si和S原子之间,故答案为选项A。答案 A
2.已知两元素A与B的原子序数分别为a、b,且原子半径B>A,则a与b的相对大小关系是( )
A.a一定大于bB.a一定小于bC.若元素A、B在同一周期,则a一定大于bD.若元素A、B不在同一周期,则a一定大于b解析 根据元素周期律可知,若A、B在同一周期,而原子半径B>A,所以原子序数a>b,C正确;若在同一主族中,当原子半径B>A时,原子序数b>a,所以两种情况都有可能,A、B、D错误。答案 C
3.用1~18号元素及其形成化合物的化学式填空。
(1)原子半径最小的元素是________。(2)除稀有气体外,原子半径最大的元素是________,它的原子结构示意图是________。(3)与水反应最剧烈的金属是________。(4)最高价氧化物对应水化物中碱性最强的是________。
(5)气态氢化物的水溶液呈碱性的元素是________。(6)最稳定的气态氢化物是________。(7)金属性最强的元素是________,非金属性最强的元素是________。(8)最高价氧化物对应的水化物中酸性最强的是___________________________。
高中化学人教版 (2019)必修 第一册第二节 元素周期律优秀ppt课件: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161998_t3/?tag_id=26" target="_blank">第二节 元素周期律优秀ppt课件</a>,共25页。PPT课件主要包含了本节重点,本节难点,半径增大,金属性增强,思考1,思考2,“一看”电子层数,“二看”核电荷数,主族元素的主要化合价,原子半径逐渐减小等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 元素周期律教学ppt课件: 这是一份人教版 (2019)必修 第一册第二节 元素周期律教学ppt课件,共33页。PPT课件主要包含了素养要求,元素性质的递变规律,当堂练习等内容,欢迎下载使用。
化学必修 第一册第二节 元素周期律教学演示课件ppt: 这是一份化学必修 第一册第二节 元素周期律教学演示课件ppt,共53页。PPT课件主要包含了目录索引等内容,欢迎下载使用。













