



人教版 (2019)选择性必修1第二节 反应热的计算说课ppt课件
展开
这是一份人教版 (2019)选择性必修1第二节 反应热的计算说课ppt课件,共34页。PPT课件主要包含了盖斯定律等内容,欢迎下载使用。
在科学研究和工业生产中,常常需要了解反应热。许多反应热可以通过实验直接测定,但是有些反应热是无法直接测定的。
例如,对于化学反应:C燃烧时不可能全部生成CO,总有一部分CO2生成(难以控制反应的程度),因此该反应的反应热是无法直接测定的。
1836年俄国化学家盖斯为了解决这一问题依据能量守恒定律,通过大量的实验证明了化学反应的焓变与化学反应的过程没有关系,只与反应物和生成物的始末状态有关,这一定律称之为盖斯定律。
一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。即在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
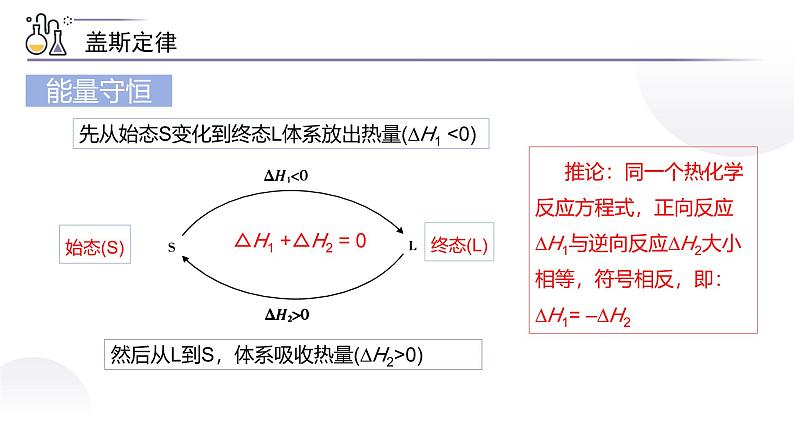
先从始态S变化到终态L体系放出热量(∆H1 0)
推论:同一个热化学反应方程式,正向反应∆H1与逆向反应∆H2大小相等,符号相反,即: ∆H1= –∆H2
经过一个循环,体系仍处于S态,因为物质没有发生变化,所以就不能引发能量变化,即∆H1+∆H2=0
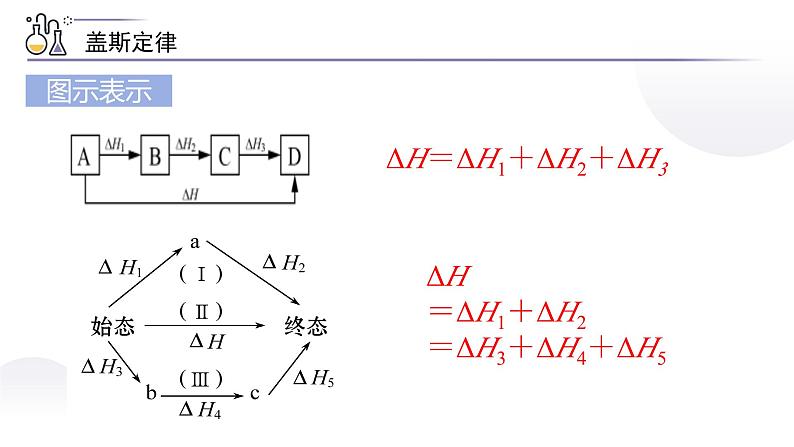
ΔH=ΔH1+ΔH2+ΔH3
ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5
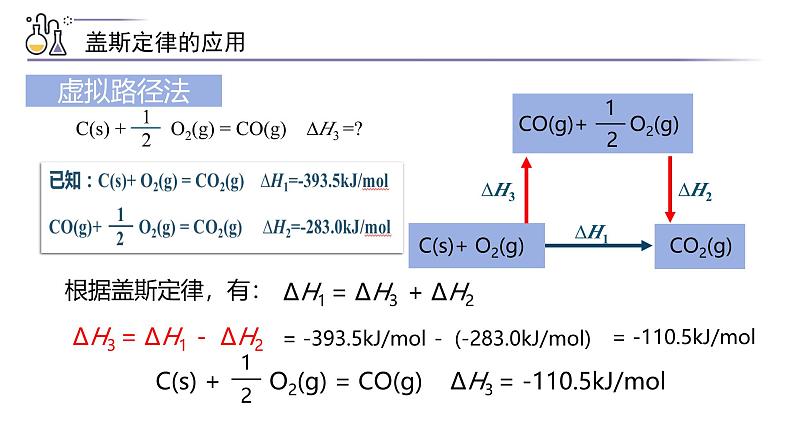
∆H1 = ∆H3 + ∆H2
∆H3 = ∆H1 - ∆H2
= -393.5kJ/ml - (-283.0kJ/ml)
= -110.5kJ/ml
即运用所给热化学方程式通过加减的方法得到所求热化学方程式。
目标方程式中的物质在给出的各个已知方程式中只出现过一次
目标方程式中的物质:与已知方程式中物质在方程式的同侧,则相加;与已知方程式中物质在方程式的异侧,则相减;
把已知方程式中的系数化成与目标方程式中物质的系数一致。
同边正号异边负 焓的变化跟系数
1、课本P19 第4题
2N2H4(l)+2NO2(g)=3N2(g)+4H2O(g) ∆H=-1134.4kJ/ml
2、课本P19 第5题
CH4(g)+2O2(g) = CO2(g) + 2H2O(l) ∆H=-890.3kJ/ml
3、课本P19 第6题
CO(g)+H2O(g) = CO2(g) + H2(g) ∆H=-41.2kJ/ml
1、课本P13 第2题
N2(g)+O2(g) = 2NO(g) ∆H=+180kJ/ml
S(s)+O2(g) = SO2(g) ∆H=-296kJ/ml
-285.72kJ/ml
Deacn直接氧化法可按下列催化过程进行:CuCl2(s)=CuCl(s)+Cl2(g) ΔH1=+83 kJ·ml-1CuCl(s)+O2(g)=CuO(s)+Cl2(g) ΔH2=-20 kJ·ml-1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·ml-1则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·ml-1。
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
CO(g)+2H2(g) CH3OH(g) △H1
天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。(1)乙烷在一定条件可发生如下反应:C2H6(g)= C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如下表所示:
ΔH=_________kJ·ml−1
研究CO2氧化C2H6制C2H4对资源综合利用有重要意义。相关的主要化学反应有:Ⅰ C2H6(g)⇌C2H4(g)+H2(g) ΔH1=136 kJ·ml−1Ⅱ C2H6(g)+CO2(g)⇌C2H4(g)+H2O(g)+CO(g) ΔH2=177 kJ·ml−1Ⅲ C2H6(g)+2CO2(g)⇌4CO(g)+3H2(g) ΔH3Ⅳ CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH4=41 kJ·ml−1已知:298K时,相关物质的相对能量(如图1)。可根据相关物质的相对能量计算反应或变化的ΔH(ΔH随温度变化可忽略)。例如:H2O(g)⇌H2O(l) ΔH4=(−286 kJ·ml−1)-(−242 kJ·ml−1)=−44 kJ·ml−1。请回答:(1)根据相关物质的相对能量计算ΔH3=________kJ·ml−1。
钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:
下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为_____________________、___________________________________,制得等量H2所需能量较少的是_____________。
相关课件
这是一份人教版 (2019)选择性必修1第二节 反应热的计算课前预习课件ppt,共18页。PPT课件主要包含了盖斯定律,盖斯定律直观化,△H=△H1+△H2,COg,CO2g,P12,盖斯定律的应用,求未知反应焓变的方法等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 反应热的计算精品ppt课件,共30页。PPT课件主要包含了答案自然是肯定的,化学史料,盖斯定律,△H=△H1+△H2,1途径角度,反应热,2能量守恒角度,盖斯定律的应用,虚拟路径法,如图所示等内容,欢迎下载使用。
这是一份2023届高中化学一轮复习微专题课件:盖斯定律在反应热计算中的应用,共17页。PPT课件主要包含了+2474,-116,+893,+10160等内容,欢迎下载使用。










