





人教版 (2019)第二节 反应热的计算一等奖ppt课件
展开【思考】在科学研究和工业生产中,常常需要了解反应热。许多反应热可以通过实验直接测定,但是有些反应热是无法直接测定的。请判断以下反应是否可以直接测定,说出你的理由。
C(s) + 1/2O2(g) = CO (g)
该反应的反应热是无法直接测定的。因为 C燃烧时不可能全部生成CO,总有一部分CO2生成。
【思考】上述反应热是冶金工业中非常有用的数据,应该如何获得呢?
利用一些已知反应的反应热是可以计算其他反应的反应热的。
1836年,化学家盖斯(, 1802- -1850) 从大量实验中总结出一条规律: 一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。这就是盖斯定律。
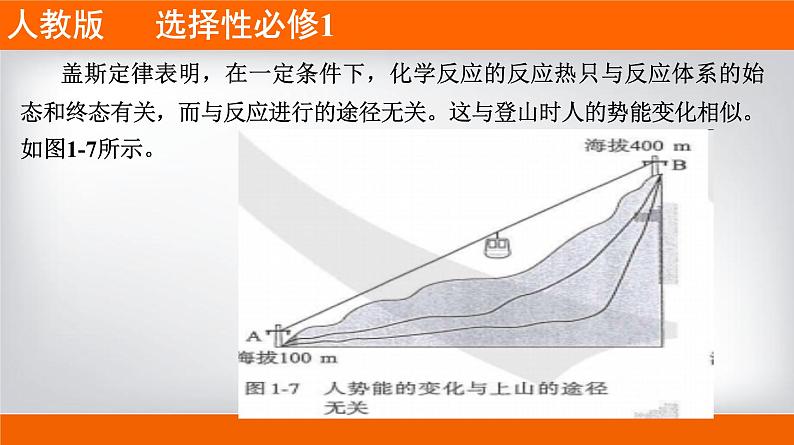
盖斯定律表明,在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应进行的途径无关。这与登山时人的势能变化相似。如图1-7所示。
【例】 已知: 求C(s) + 1/2O2(g) = CO (g) △H3 = ?
C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/ml
CO(g)+1/2O2(g)=CO2(g) △H2=-283.0 kJ/ml
C(s)+1/2O2(g)==CO(g)
CO(g)+1/2O2(g)=CO2(g)
C(s)+O2(g)=CO2(g)
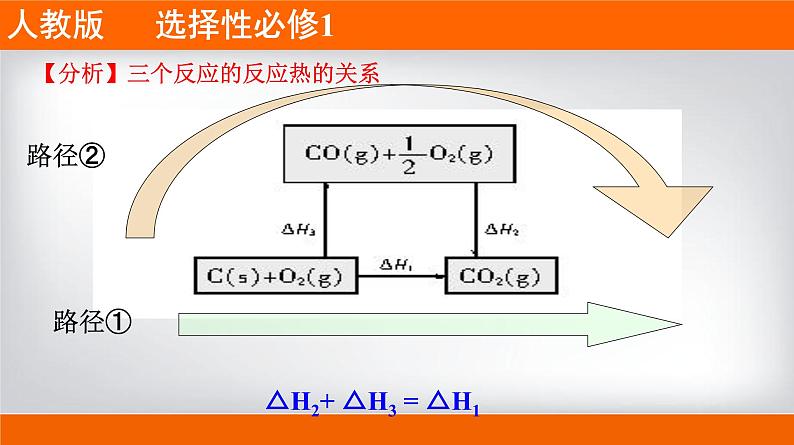
【分析】三个反应之间的关系:
△H2+ △H3 = △H1
【分析】三个反应的反应热的关系
△H3 = △H1 - △H2 = -393.5 KJ/ml - (-283.0 KJ/ml ) =-110.5 KJ/ml
即: C(s) + 1/2O2(g) = CO (g) △H3 =-110.5 KJ/ml
【结论】若某个反应的化学方程式可由另外几个反应的化学方程式相加减而得到,则该反应的反应热也可以由这几个反应的反应热相加减而得到。
【例题1 】黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2的途径之一 ,反应的化学方程式为:在25 0C和101 kPa时,1 ml FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853 kJ的热量。这些热量(工业中叫做“废热”)在生产过程中得到了充分利用,大大降低了生产成本,对于节约资源、能源循环利用具有重要意义。(1)请写出FeS2燃烧的热化学方程式。(2)计算理论上1 kg黄铁矿(FeS2的含量为90%)完全燃烧放出的热量。
【视觉1】根据质量或物质的量计算反应热
(2) FeS2的摩尔质量为120 g/ml。
【例题2 】葡萄糖是人体所需能量的重要来源之一,设它在人体组织中完全氧化时的热化学方程式为:计算100 g葡萄糖在人体组织中完全氧化时产生的热量。
根据热化学方程式可知,1 ml C6H12O6在人体组织中完全氧化时产生的热量为2800 kJ。 C6H12O6的摩尔质量为180g/ml。100 g C6H12O6的物质的量为: 100g/ 180g/ml=0.556 ml0.556 ml C6H12O6完全氧化时产生的热量为: 0.556 ml* 2800 KJ/ml=1557KJ
【例题3 】焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别为:
【视觉2】根据盖斯定律计算反应热
【解】分析各化学方程式的关系可以得出,总反应为反应①的逆反应与反应②相加,即:
【小结】利用盖斯定律进行反应热的计算注意: 1、热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减;2、分析各热化学方程式关系, 看系数扩倍数 反写成逆反应时H要变号
1. 沼气是一种能源,它的主要成分是CH4。0.5 ml CH4完全燃烧生成CO2和液态H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是()A. 2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) ΔH=+890 kJ/mlB. CH4+2O2=CO2+H2O ΔH=-890 kJ/mlC. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mlD.1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l) ΔH=-890 kJ/ml
2. (1)0.3 ml的气态高能燃料乙硼烷(B2H6)在氧气中完全燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为 。(2)常温下14克CO在足量氧气中充分燃烧,放出141.3 KJ热量,写出该热化学方程式。
B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H= -2165 kJ/ml
CO(g)+1/2O2(g)=CO2(g) △H=-282.6 kJ/ml
3.(1)已知:S(s)+O2(g)=SO2(g) △H=-290.6 kJ/ml求1.6克硫燃烧成为SO2气体放出多少热量?(2)已知:C(s)+O2(g)=CO2(g) △H=-393.5 kJ/ml要获得1000千焦热量,需燃烧多少克碳?
4.在298K、100kPa时,已知:
则△H1与△H2和△H3间的关系正确的是:A、 △H3 = △H1+2△H2 B、 △H3 = △H1+△H2 C、 △H3 = △H1—2△H2 D、 △H3 = △H1—△H2
5. 同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:
①P4(s、白磷)+5O2(g)=P4O10(s) △H1 = -2983.2 kJ/ml
②P(s、红磷)+5/4O2(g)=1/4P4O10(s) △H2= -738.5 kJ/ml
试写出白磷转化为红磷的热化学方程式_________________________________。
P4(s、白磷)=4 P(s、红磷) △H= -29.2 kJ/ml
6.已知: H2O(g)==H2O(l) △H2=-44kJ/ml H2(g)+1/2O2(g)==H2O(g) △H1=-241.8kJ/ml(1)H2的燃烧热△H是多少?(2)表示氢气燃烧热的热化学方程式?
H2(g)+1/2O2(g)==H2O(l) △H=-285.8kJ/ml
△H=△H1+△H2= -285.8kJ/ml
7.利用N2H4(肼)在NO2中燃烧,生成N2、气态H2O,是火箭发射常用的反应之一。已知:N2(g)+2O2(g)=2NO2(g) △H1=+8.7kJ/ml N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=-534kJ/ml 假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)=3N2(g)+4H2O(g) △H=-1076.6kJ/ml
高中化学人教版 (2019)选择性必修1第二节 反应热的计算示范课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 反应热的计算示范课课件ppt,共21页。PPT课件主要包含了学习目标,课前导入,知识点一,盖斯定律,①从反应途径分析,②从能量守恒分析,始态S,终态L,盖斯定律的应用,1虚拟路径法等内容,欢迎下载使用。
化学第一章 化学反应的热效应第二节 反应热的计算完美版ppt课件: 这是一份化学第一章 化学反应的热效应第二节 反应热的计算完美版ppt课件,共17页。PPT课件主要包含了学习目标,这是什么规律,学习任务一盖斯定律,△H=△H1+△H2,殊途同归,1途径角度,反应热,2能量守恒角度,CO2g,△H1等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 反应热的计算精品ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二节 反应热的计算精品ppt课件,共30页。PPT课件主要包含了答案自然是肯定的,化学史料,盖斯定律,△H=△H1+△H2,1途径角度,反应热,2能量守恒角度,盖斯定律的应用,虚拟路径法,如图所示等内容,欢迎下载使用。













