





高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物课堂教学ppt课件
展开《三国演义》第89回: 后主建兴三年(公元225年)诸葛亮为了擒拿南王孟获(历史上有名的七擒七纵),率军南征至云南西洱河,遇四口毒泉。其中一口为“哑泉”。
时逢天气好生炎热,人马饮用了哑泉泉水后,一个个说不出话来,后来得一智者指教,复饮“安乐泉”泉水。
哑泉“人若饮之,则不能言,不过旬日必死”。
安乐泉“随即吐出恶涎,便能言语”。
1995年10月国内某刊报道,经研究“哑泉”水中溶有CuSO4,“安乐泉”水质偏碱性。
“安乐泉”能解“哑泉”之毒的原理可能为Cu2+ + 2OH- = Cu(OH)2↓
“安乐泉”解“哑泉”之毒
1、电解质:在水溶液里或熔融状态下能够导电的化合物。
2、非电解质:在水溶液里和熔化状态下都不导电的化合物。
3、电离: 电解质在水溶液里或熔融状态下产生自由移动离子的过程。
① 液态氯化氢 ② 酒精 ③ 食盐水 ④ Cl2 ⑤ CaO固体 ⑥ BaSO4固体 ⑦ SO3 ⑧石墨 ⑨熔融KNO3 属于电解质的是 , 属于非电解质的是 。 能导电的有 。
电解质溶液能导电的原因:
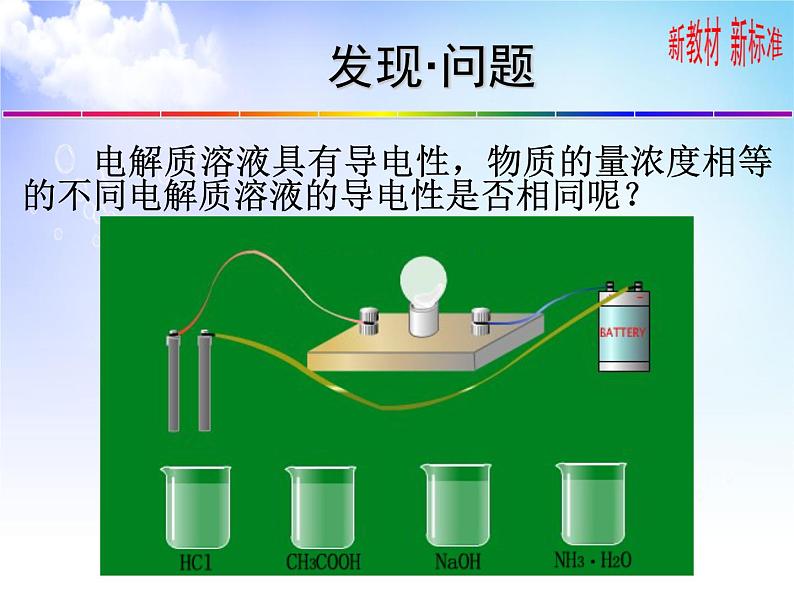
电解质溶液具有导电性,物质的量浓度相等的不同电解质溶液的导电性是否相同呢?
为什么相同浓度的溶液,其离子浓度不同呢?
导电能力与什么有关? 与离子浓度的大小有关。
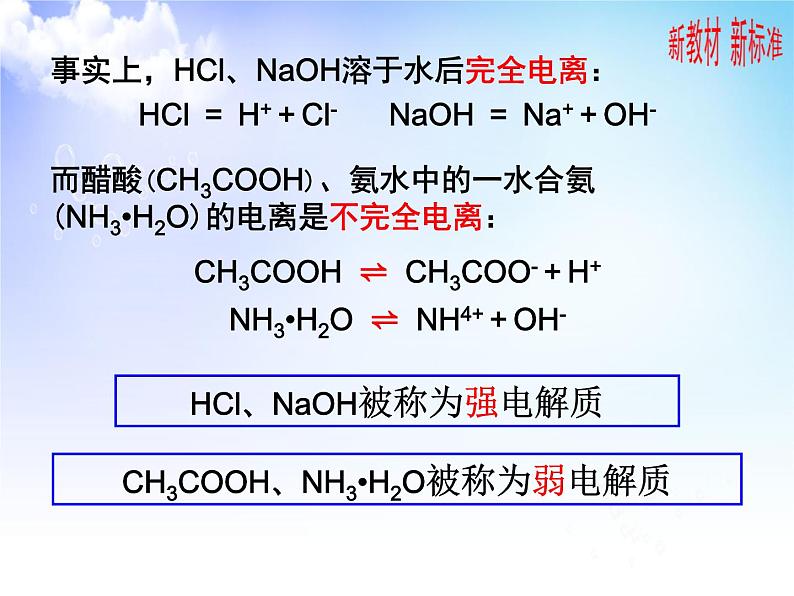
事实上,HCl、NaOH溶于水后完全电离:HCl = H+ + Cl- NaOH = Na+ + OH-
HCl、NaOH被称为强电解质
CH3COOH、NH3•H2O被称为弱电解质
而醋酸(CH3COOH)、氨水中的一水合氨(NH3•H2O)的电离是不完全电离:CH3COOH ⇌ CH3COO- + H+NH3•H2O ⇌ NH4+ + OH-
一、强电解质和弱电解质
1.强电解质:在水溶液里完全电离成离子的电解质。 比如:强酸、强碱、大多数盐。
2.弱电解质:在水溶液里部分电离成离子的电解质。 比如:弱酸、弱碱、水。
1.难溶性物质就一定是弱电解质吗? 2.溶解度大的物质就一定是弱电解质吗?
(3)大部分盐:如NaCl、CaCl等, 包括部分难溶性盐CaCO3、BaSO4、AgCl等
如HCl、H2SO4、HNO3、HClO4、 HBr、HI等
如NaOH、KOH、Ba(OH)2等
(4)活泼金属氧化物:Na2O
如CH3COOH、H2CO3、H2SiO3、 H3PO4、H2SO3、HNO2、H2S、HF、HClO等
(2)弱碱:(3)两性氢氧化物:Al(OH)3(4)水、极少数盐(醋酸铅)等
如NH3.H2O、Cu(OH)2、Fe(OH)3等
1、下列物质属于电解质的是:__________ 属于强电解质的是:________ 属于弱电解质的是:________ 属于非电解质的是:________ ①AgCl ②乙醇 ③HNO3 ④HF ⑤金属钠 ⑥干冰 ⑦NaHCO3 ⑧浓硫酸 ⑨盐酸 ⑩NH3·H2O
NH3·H2O ⇌ NH4+ + OH- HF ⇌ F- + H+
2、下列说法正确的是 ( ) A. 强电解质导电能力很强,弱电解质导电能力很弱。 B. 强电解质一定易溶于水,弱电解质一定难溶于水。 C. CO2的水溶液导电能力很弱,所以CO2是弱电解质 D. 同浓度同体积的硝酸和醋酸相比,硝酸的导电能力 比醋酸强。
3、写出下列物质的电离方程式:
Na2CO3 = 2Na+ + CO32-Ca(OH)2 = Ca2+ + 2OH-HF ⇌ H+ + F-H2CO3 ⇌ H+ + HCO3- 第一步(主要)HCO3- ⇌ H+ + CO32- 第二步(次要)
多元弱酸分步电离,以第一步电离为主
Na2CO3 Ca(OH)2 HF H2CO3
在Na2CO3的性质实验中,我们观察了Na2CO3溶液分别与澄清石灰水和CaCl2溶液反应的现象,上述的实质是否相同?
本质:都是CO32-和Ca2+之间的反应CO32- + Ca2+ = CaCO3↓
像这种式子称为离子方程式。
1. 定义:把有离子参加或离子生成的化学反应称为离子反应。2. 表示形式:离子方程式。
用实际参加反应的离子符号来表示离子反应的式子叫离子方程式。
CO32- + Ca2+ = CaCO3↓
② 离子方程式的书写步骤
(以碳酸钠与盐酸反应为例)
Na2CO3 + 2HCl == 2NaCl + CO2↑+ H2O
2Na+ + CO32- + 2H+ + 2Cl- == 2Na+ + 2Cl- + CO2↑+ H2O
反应物和生成物中的弱酸、弱碱、水、不溶的物质和气体全部写化学式,单质、氧化物也均写化学式。
氧化物Na2O、SO3
难溶物CaCO3BaSO4
弱电解质弱酸的酸式根H2CO3、H2OHCO3-、HPO4-
小结:“写、拆、删、查”
如: Fe2++Cl2=Fe3++2Cl-
应当改为:2Fe2++Cl2=2Fe3++2Cl-
CO32- + 2H+ == CO2↑+ H2O
2.固体与浓硫酸反应,不写离子方程式;
1.固体之间的反应一般不写离子反应方程式;
3.反应中的微溶物:反应物处于溶液中时写成离子形式,处于浊液或者固体时写成分子形式;生成物中的微溶物一律写化学式。
如澄清石灰水与稀盐酸反应:OH- + H+ == H2O
如石灰乳与稀硫酸反应:Ca(OH)2 + 2H+ + SO42- == 2H2O + CaSO4
4.铵盐与碱的反应,条件不同,离子方程式写法不同;
5.反应物的量不同,离子方程式也会不同;
NaOH溶液中通入少量CO2:2OH- + CO2 == CO32- + H2O
NaOH溶液中通入过量CO2:OH- + CO2 == HCO3-
6.有酸式盐参加的某些反应。
某些酸式盐的酸根:HSO4-、HCO3-、H2PO4-、HPO42-、HS- 只有 HSO4- 可以写成 SO42- 和 H+ ,其它酸根一律不能拆。
离子方程式的书写:(1)Cl2 + NaOH (2)Fe + H2SO4 (稀)(3)Na + H2O (4)MnO2 + HCl (浓)(5)H2SO4 + Ba(OH)2
③ 离子反应发生的条件
(1)生成难溶的物质,如 AgCl、BaSO4、CaCO3、Cu(OH)2
(3)生成难电离的物质,如 弱酸、弱碱、水
(2)生成挥发性的物质,如 H2、CO2、NH3、H2S、Cl2
(4)发生氧化还原反应
BaCl2 + Na2SO4 == BaSO4↓+ NaCl Ba2+ + SO42- == BaSO4↓
HCl + Na2CO3 == H2O + CO2↑+ 2NaCl 2H+ + CO32- == H2O + CO2↑
HCl + NaOH == H2O + NaCl H+ + OH- == H2O
1、暖水瓶使用一段时间后,壶胆内壁会形成一层水垢(组成为碳酸钙、氢氧化镁),水垢可用稀盐酸、醋酸来溶解而除去。请写出其反应的离子方程式。
b.用醋酸CaCO3 + 2CH3COOH == Ca2+ + 2CH3COO- + H2O + CO2 ↑ Mg(OH)2 + 2CH3COOH == Mg2+ + 2CH3COO- + 2H2O
a.用稀盐酸CaCO3 + 2H+ == Ca2+ + H2O + CO2 ↑ Mg(OH)2 + 2H+ == Mg2+ + 2H2O
2、下列离子方程式书写正确的是( ) A.碳酸钡与稀硫酸反应 CO32- + 2H+ == CO2↑+ H2O B.硫酸和氯化钡溶液反应 Ba2+ + SO42- == BaSO4↓ C.氢氧化钙和少量二氧化碳反应 2OH- + CO2 + Ca2+ == CaCO3↓+ H2O D.铁钉放入硫酸铜溶液中 Fe + 3Cu2+ == Fe3+ + 3Cu
离子方程式书写正确的判断依据:
(1)是否符合客观事实
(3)方程式是否配平(原子守恒、电荷守恒)
3、下列离子方程式的书写正确的是( ) A.实验室用大理石和稀盐酸制取CO2:
B.醋酸和氢氧化钠溶液反应:
C.铜和氯化铁溶液反应:
D.氢氧化铁和盐酸反应:
CH3COOH + OH- == CH3COO- + H2O
Cu + Fe3+ == Cu2+ + Fe2+
OH- + H+ == H2O
根据离子方程式的书写步骤写出下列反应的离子方程式。 (1)盐酸与氢氧化钠溶液反应.(2)硫酸与氢氧化钾溶液反应.(3)盐酸与氢氧化钡溶液反应.(4)硝酸溶液与氢氧化钡溶液反应.
H+ + OH- = H2O
一个离子反应不仅可表示一定物质间的反应,而且可表示所有同一类型的反应,揭示了反应的实质。
例如: H+ + OH- = H2O
这一离子方程式可以表示强酸和强碱生成可溶性盐和水的这一类中和反应。
(1)离子间反应生成难溶的物质(沉淀);(2)离子间反应生成挥发性的物质(气体);(3)离子间反应生成难电离的物质(弱酸、弱碱或水等);(4)离子间发生氧化还原反应。
离子间不能共存的情况有四种:
1. 下列各组中的离子,能够大量共存的是( )
2.下列各组离子,在强碱性溶液中可以大量共存的是( )
3、某无色溶液在滴加石蕊试液时呈红色,在此溶液中能 大量共存的离子组是( )
4、在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
5、下列溶液中的各组离子,因发生氧化还原反应而不能大量共存的是( ) A.H+、Na+、NO3-、SO32- B.MnO4-、Fe2+、Na+、NH4+ C.Fe3+、SCN-、SO42-、Cl- D.Fe3+、HCO3-、Cl-、NH4+
(1) 溶液无色透明时,则不能存在有色离子; (Fe3+、MnO4-、Fe2+、Cu2+)(2) 强酸性溶液中不能存在与H+反应的离子; (H+和弱酸根如 CO32-、HCO3-、F-、CH3COO-、S2-等)(3) 强碱性溶液中不能存在与OH-反应的离子; (OH-和弱碱根如 NH4+、Mg2+ 、Ag+等)(4) 既不能跟H+又不能跟OH-大量共存 所有的多元弱酸的酸式酸根 (如HCO3-、HSO3-、HS-等)。
6、一种无色溶液中加入BaCl2溶液,生成不 溶于稀HCl的白色沉淀,则该溶液中含有 的离子是( ) A. 一定含有SO42- B. 一定含有CO32- C. 一定含有Ag+ D. 可能含有SO42-,也可能含有Ag+
7、向某溶液中加入过量盐酸生成白色沉淀;过滤 后向滤液中加入过量的氨水,又有白色沉淀生 成,原溶液中含有的离子可能是( ) A. Na+、Cu2+ B. Ag+、Al3+ C. Ag+、Ca2+ D. Al3+、Mg2+
8、实验室中有甲、乙两种含毒性的重金属离子的 废液,甲废液呈碱性,主要含有毒离子Ba2+, 如将甲、乙两废液按一定比例混合,毒性明显 降低。则乙废液中可能含有的离子是( ) A. Cu2+和SO42- B. Cu2+和Cl C. K+和SO42- D. Ag+和NO3
1、在酸性溶液中Fe2+与MnO4-能否共存?2、向同浓度NaBr与NaI的混合溶液中通入氯气,哪种离子先被氧化?3、向同浓度的Cu(NO3)2与AgNO3混合溶液中加入铁屑,哪种离子先被还原?
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物示范课课件ppt: 这是一份苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物示范课课件ppt,共16页。PPT课件主要包含了复习旧知,导电性实验等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物优秀课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物优秀课件ppt,共18页。PPT课件主要包含了学习目标,课程导入,学习探究,灯很亮,灯稍暗,弱酸水,强碱强酸,某些共价化合物,水合离子,离子反应等内容,欢迎下载使用。
苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物背景图ppt课件: 这是一份苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物背景图ppt课件,共43页。PPT课件主要包含了学业基础,不能完全,离子方程式,易挥发,难电离,答案D,答案B,答案CD,核心素养,答案C等内容,欢迎下载使用。













