

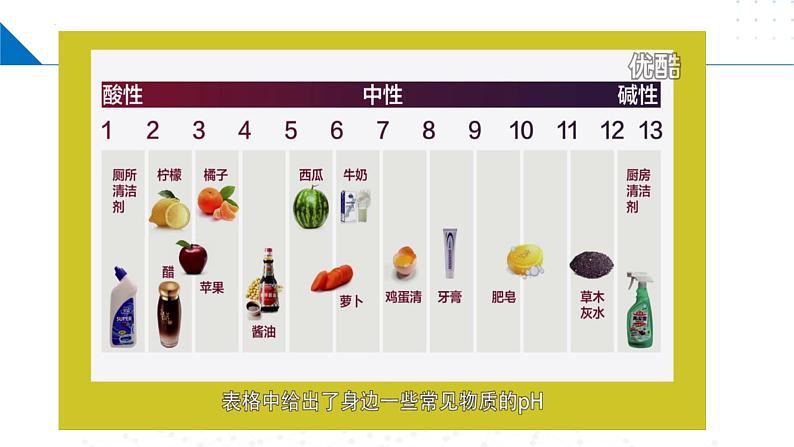



苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第二单元 溶液的酸碱性评优课课件ppt
展开1.通过掌握溶液酸碱性与pH的关系,培养宏观辨识与微观探析的化学核心素养。2.通过学会计算酸碱的pH以及氢离子浓度和pH的互算,培养证据推理与模型认知的化学核心素养。
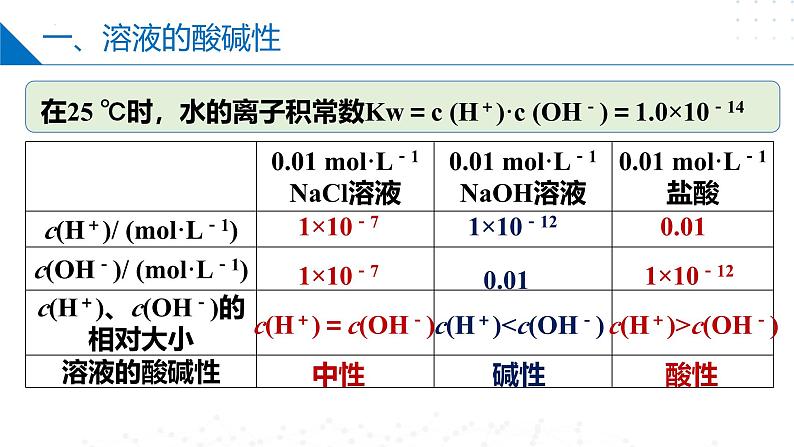
在25 ℃时,水的离子积常数Kw=c (H+)·c (OH-)=1.0×10-14
c(H+)=c(OH-)
c(H+)
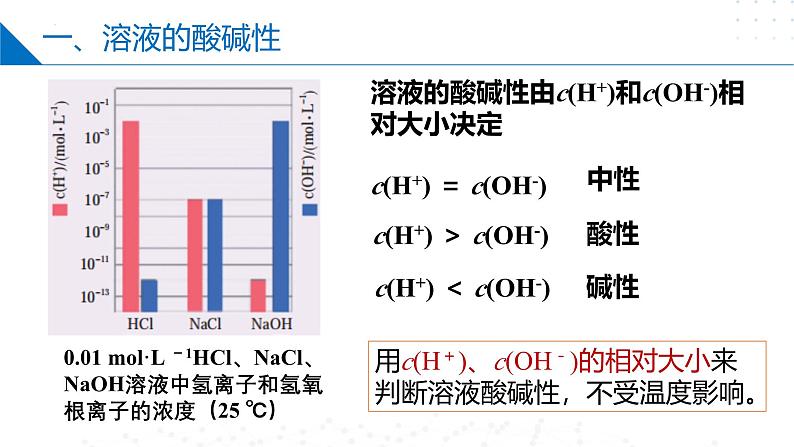
溶液的酸碱性由c(H+)和c(OH-)相对大小决定
0.01 ml·L -1HCl、NaCl、NaOH溶液中氢离子和氢氧根离子的浓度(25 ℃)
c(H+) = c(OH-)
用c(H+)、c(OH-)的相对大小来判断溶液酸碱性,不受温度影响。
pH=-lgc(H+)
pH的大小能反映出溶液中c(H+)的大小,即表示稀溶液酸、碱性的强弱。
用H+物质的量浓度的负对数来表示溶液酸碱性。
pH值越大碱性越强,pH越小酸性越强。
pH的适用范围:c(H+)和c(OH-)都较小的稀溶液(小于1 ml•L-1)
1×10-14 ml·L-1≤c(H+)≤1 ml·L-1,即0≤pH≤14。
当c(H+)或c(OH-)大于1 ml•L-1时,通常用c(H+)或c(OH-)直接表示。
溶液的pH与溶液中氢离子浓度的关系(25 ℃)
当pH<7时,溶液中c(H+)大于c(OH-),溶液显酸性,且pH越小,溶液中c(H+)越大,溶液的酸性越强;
当pH>7时,溶液中c(H+)小于c(OH-),溶液显碱性,且pH越大,溶液中c(OH-)越大,溶液的碱性越强。
例1(1)c (H+)=1.0×10-6 ml/L pH= ; c (H+)=1.0×10-3 ml/L pH= ; c (H+)=1.0×10-m ml/L pH= ; c (OH-)=1.0×10-6 ml/L pH= 。 c (OH-)=1.0×10-10 ml/L pH= 。 c (OH-)=1.0×10- n ml/L pH= 。 (2)pH=2 c (H+)= ; pH=8 c(H+)= 。
1.0×10-2 ml/L
1.1×10-8 ml/L
1、当pH=7时,溶液中氢离子浓度和氢氧根离子浓度相等,溶液显中性,对吗?
不对,未指明温度,不一定呈酸性。
2、pH等于0的溶液是酸性最强的溶液,pH等于14的溶液是碱性最强的溶液。
不对。pH等于0的溶液中c(H+)=1 ml•L-1,不是酸性最强的溶液;pH等于14的溶液c(OH-)=1 ml•L-1,不是碱性最强的溶液。
酸碱指示剂法(只能测定溶液的pH范围)
取一小块pH试纸于干燥洁净的玻璃片或表面皿上,用干燥洁净的玻璃棒蘸取试液点在试纸上,当试纸颜色变化稳定后迅速与标准比色卡对照,读出pH。
使用pH试纸的正确操作为:
pH计可精确测量溶液的pH(读至小数点后2位)。
用pH传感器(pH探头)
1、用pH试纸测定溶液pH时为什么不能润湿?
若润湿pH试纸会将溶液稀释,所测溶液pH可能有误差。
2、为什么不能用pH试纸测NaClO溶液的pH?
NaClO溶液具有强氧化性,会将pH试纸漂白。
口诀:酸按酸(H+),碱按碱(OH-),酸碱中和求过量,无限稀释7为限。
pH计算——公式中c(H+):若强酸溶液:c(H+)=n·c(HnA)
(1)单一溶液pH的计算
(2)混合溶液pH的计算
酸碱发生中和反应后溶液pH的判断技巧(1)酸与碱的pH之和为14,等体积混合常温时
原因:酸和碱已电离的H+和OH-恰好中和,谁弱谁的H+或OH-有储备(即物质过量),中和后还能继续电离。
酸碱发生中和反应后溶液pH的判断技巧
例2 求常温下,下列溶液的pH(已知lg 5=0.7):(1)某H2SO4溶液的浓度是0.005 ml•L-1,此溶液的pH为___。
(2)0.001 ml•L-1 NaOH溶液的pH为____。
(3)pH=3的盐酸与pH=5的硫酸等体积混合,pH为_____。
(4)pH=10和pH=12的两种NaOH溶液等体积混合,pH为______。
(5)pH=12的NaOH溶液和pH=4的HCl溶液等体积混合,pH为______。
常温下,pH只能无限接近于7,酸溶液pH不可能大于7,碱溶液pH不可能小于7。
溶液稀释后的pH变化规律
常温下,每稀释到原溶液体积的10n倍,强酸的pH就增大n个单位,即pH=a+n(a+n<7),弱酸的pH范围是:a
常温下,每稀释到原溶液体积的10n倍,强碱的pH减小n个单位,即pH=b-n(b-n>7),弱碱的pH范围是:b-n(b-n>7)
强酸pH变化程度比弱酸大(强碱和弱碱类似)。弱酸、弱碱在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范围。
4.对于物质的量浓度相同的强酸和弱酸稀释相同倍数
可以看出无论是c相等还是pH相等,加水稀释相同倍数pH变化大的都是强酸或强碱。
例3 pH=12的X、Y两种碱溶液,分别将它们稀释100倍,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )A.若10
计算思路计算类型及方法溶液稀释pH变化图像
1、某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )A.曲线Ⅰ代表HNO2溶液B.取相同体积b、c两点的溶液,分别与NaOH恰好中和后,b点对应溶液中n(Na+)更大C.取等体积a点的两种溶液,稀释到相同的pH,CH3COOH所需水的体积更小D.相应酸的电离程度:d点>c点,溶液导电性:d点>c点
高中苏教版 (2019)专题3 水溶液中的离子反应第二单元 溶液的酸碱性多媒体教学课件ppt: 这是一份高中苏教版 (2019)<a href="/hx/tb_c4009321_t3/?tag_id=26" target="_blank">专题3 水溶液中的离子反应第二单元 溶液的酸碱性多媒体教学课件ppt</a>,共1页。
鲁科版 (2019)选择性必修1第1节 水与水溶液教学课件ppt: 这是一份鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002587_t3/?tag_id=26" target="_blank">第1节 水与水溶液教学课件ppt</a>,共21页。PPT课件主要包含了0×10-12,0×10-11,溶液呈酸性,溶液呈碱性,1一般情况下,2室温下,常温下,pH=7,pH<7,pH>7等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第二单元 溶液的酸碱性评优课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第二单元 溶液的酸碱性评优课课件ppt,共40页。PPT课件主要包含了课前导入,cH+越大,pH越小,溶液酸碱性的判断,习题研究等内容,欢迎下载使用。













