





苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第二单元 溶液的酸碱性优秀ppt课件
展开1.掌握溶液的酸碱性与pH的关系。
2.掌握测定溶液pH的方法,了解溶液pH调控的意义。
3.掌握计算溶液pH的方法。
一、溶液的酸碱性与pH
二、溶液稀释后的pH变化规律
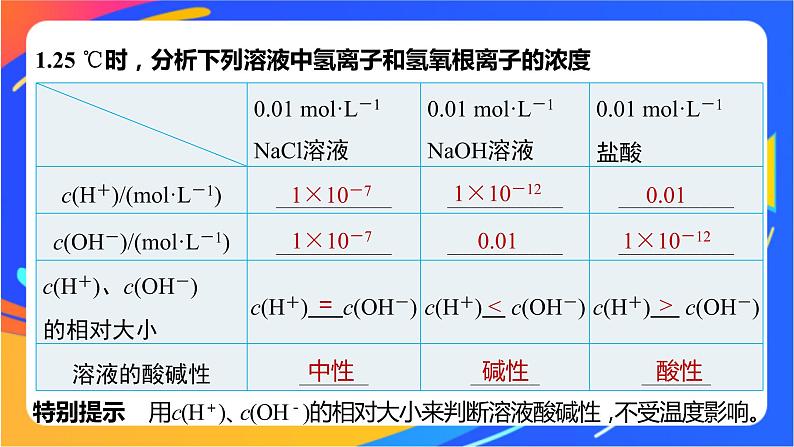
1.25 ℃时,分析下列溶液中氢离子和氢氧根离子的浓度
特别提示 用c(H+)、c(OH-)的相对大小来判断溶液酸碱性,不受温度影响。
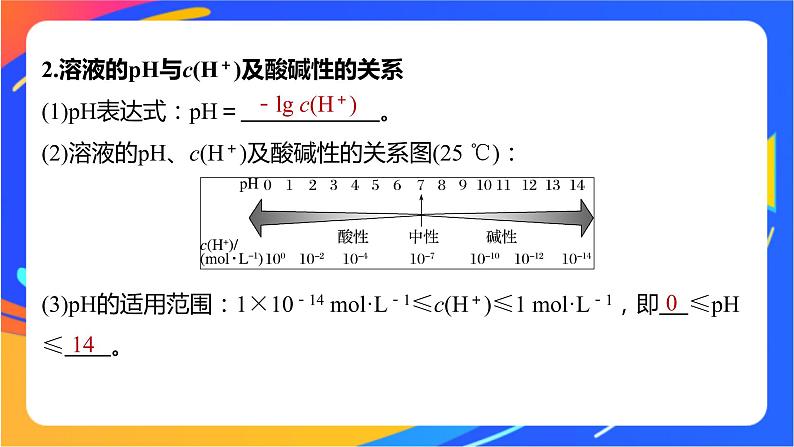
2.溶液的pH与c(H+)及酸碱性的关系(1)pH表达式:pH= 。(2)溶液的pH、c(H+)及酸碱性的关系图(25 ℃):
(3)pH的适用范围:1×10-14 ml·L-1≤c(H+)≤1 ml·L-1,即 ≤pH≤ 。
3.溶液酸碱性的测定方法(1)酸碱指示剂法(只能测定溶液的pH范围)(2)利用pH试纸测定。使用pH试纸的正确操作为取一小块pH试纸于干燥洁净的 ,用干燥洁净的玻璃棒蘸取试液点在试纸上,当试纸颜色变化稳定后迅速与 对照,读出pH。(3)利用pH计测定。pH计可精确测量溶液的pH(读至小数点后2位)。(4)用pH传感器(pH探头)测定。
(1)任何温度下,如果c(H+)不等于c(OH-),则溶液一定呈现酸碱性( )(2)某溶液的pH=7,该溶液一定显中性( )(3)升高温度,水的电离程度增大,酸性增强( )(4)用蒸馏水润湿的pH试纸测溶液的pH,一定会使结果偏低( )(5)常温下,加入酚酞显无色的溶液一定显酸性( )(6)用pH计测得某溶液的pH为7.45( )
1.某溶液中c(H+)=1×10-6 ml·L-1,该溶液一定呈酸性吗?
提示 未指明温度,不一定呈酸性。
2.(1)pH试纸使用前能否用蒸馏水润湿?若用湿润的pH试纸测定溶液的pH对结果有何影响?
提示 使用pH试纸不能用蒸馏水润湿,润湿后相当于稀释了溶液。若为酸性溶液,则润湿后测得pH偏大;若为碱性溶液,则润湿后测得pH偏小;若为中性溶液,则无影响。
(2)某同学用pH试纸测定新制氯水的pH为1.0,他的结论正确吗?
提示 新制氯水具有漂白性,不能使用pH试纸进行测定,其结论错误。
(3)现欲测定100 ℃沸水的pH及酸碱性,甲同学使用pH试纸测定,请推测pH试纸呈什么颜色,溶液的酸碱性如何?
提示 pH试纸呈淡黄色,沸水呈中性。
测溶液pH时的三注意(1)不能用湿润的玻璃棒蘸取待测液,也不能将pH试纸先用水润湿,否则会将溶液稀释,可能导致所测定的pH不准确,使酸性溶液的pH变大,碱性溶液的pH变小,但中性溶液不受影响。(2)若某溶液具有漂白性,则不能用酸碱指示剂测定该溶液的酸碱性,也不能用pH试纸测定其pH。(3)pH试纸不能测c(H+)>1 ml·L-1或c(OH-)>1 ml·L-1的溶液的pH。
1.下列溶液一定显酸性的是A.溶液中c(OH-)>c(H+)B.滴加紫色石蕊溶液后变红色的溶液C.溶液中c(H+)=10-6 ml·L-1D.常温时,溶液中由水电离的c(H+)=10-9 ml·L-1
判断溶液酸碱性的关键是看c(H+)和c(OH-)的相对大小,若c(H+)>c(OH-),溶液呈酸性;而pH<7或c(H+)>10-7 ml·L-1的溶液呈酸性,仅适用于常温时,若温度不确定,就不能用来判断溶液的酸碱性。B项中可使紫色石蕊溶液变红,则该溶液显酸性;D项中水电离的c(H+)<10-7 ml·L-1,说明向水中加入了抑制水电离的酸或者是碱,溶液的酸碱性不能确定。
2.已知某温度下纯水的pH=6。请回答下列问题:(1)pH=7的溶液呈 (填“酸性”“中性”或“碱性”)。(2)该温度下,0.1 ml·L-1的盐酸的pH= 。水电离出的H+浓度为 。
1×10-11 ml·L-1
溶液稀释后的pH变化规律
1.酸碱溶液无限稀释常温下,pH只能无限 ,酸溶液pH不可能 ,碱溶液pH不可能 。2.对于pH=a的强酸和弱酸溶液稀释
常温下,每稀释到原溶液体积的10n倍,强酸的pH就增大 个单位,即pH= ,弱酸的pH范围: ,可用如图表示。
a
b-n(b-n>7)
1.常温下,下列关于溶液的稀释说法正确的是A.pH=3的醋酸溶液稀释100倍,pH=5B.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)= 1×10-6 ml·L-1C.将1 L 0.1 ml·L-1的Ba(OH)2溶液稀释为2 L,pH=13D.pH=8的NaOH溶液稀释100倍,其pH=6
A项,pH=3的醋酸溶液在稀释过程中电离平衡正向移动,稀释100倍时,3
若a=b,稀释后的CH3COOH溶液pH<5,若使稀释后CH3COOH溶液pH=5,就必须继续加水稀释,即a
A项,等体积0.10 ml·L-1的MOH和ROH,前者pH=13,后者pH小于13,说明前者是强碱,后者是弱碱,正确;B项,ROH是弱碱,加水稀释,促进电离,b点电离程度大于a点,正确;
C项,两溶液无限稀释,溶液近似呈中性,c(OH-)相等,正确;D项,由MOH是强碱,在溶液中完全电离,所以c(M+)不变,ROH是弱碱,升高温度,促进电离平衡ROH R++OH-向右移动,c(R+)增大,所以 减小,错误。
题组一 溶液酸碱性的判断与pH1.下列说法正确的是A.某溶液中c(H+)=c(OH)-=10-6 ml·L-1,该溶液呈中性B.溶液中若c(H+)>10-7 ml·L-1,则c(H+)>c(OH-),溶液显酸性C.c(H+)越大,则pH越大,溶液的酸性越强D.pH为0的溶液,其中只有H+,无OH-
溶液呈中性的本质原因是c(H+)=c(OH-),所以该溶液呈中性,A项正确;溶液的酸碱性取决于溶液中c(H+)与c(OH-)的相对大小,当溶液中c(H+)>c(OH-)时,溶液呈酸性,溶液中若c(H+)>10-7 ml·L-1 ,不一定就说明c(H+)大于c(OH-),如100 ℃时的NaCl溶液中c(H+)>10-7 ml·L-1,溶液呈中性,B项错误;溶液的酸碱性可用pH表示,其计算公式为pH=-lg c(H+),所以c(H+)越大,pH越小,C项错误;
pH为0的溶液,c(H+)=1 ml·L-1,任何水溶液中都存在水的电离平衡,既存在H+也存在OH-,D错误。
2.我们常见的一些食物在室温时的近似pH如表,则下列说法不正确的是
A.鸡蛋清显碱性B.胃酸过多的人应少吃泡菜C.橘子汁能使石蕊溶液变红D.牛奶比鸡蛋清的碱性强
3.在25 ℃时,某稀溶液中由水电离产生的c(OH-)=10-10 ml·L-1。下列有关该溶液的叙述正确的是A.该溶液一定呈酸性B.该溶液中c(H+)可能等于10-5 ml·L-1C.该溶液的pH可能为4,也可能为10D.该溶液可能呈中性
25 ℃时,某稀溶液中由水电离产生的c(OH-)=10-10 ml·L-1<10-7 ml·L-1,说明水的电离受到抑制,所以该溶液可能呈酸性,也可能呈碱性,不可能呈中性,A、D项错误;如果该溶液呈酸性,则该溶液中c(H+)= ml·L-1=10-4 ml·L-1,溶液的pH=4,如果该溶液呈碱性,则该溶液中c(H+)=10-10 ml·L-1,溶液的pH=10,B项错误,C项正确。
题组二 pH的测定及计算4.用pH试纸测定某无色溶液的pH,下列说法正确的是A.将pH试纸放入溶液中,观察其颜色变化并与标准比色卡对照B.用广范pH试纸测得氯水的pH为2C.用干燥、洁净的玻璃棒蘸取溶液,滴在pH试纸上,观察其颜色并与标 准比色卡对照D.用干燥、洁净的玻璃棒蘸取溶液,滴在湿润的pH试纸上,测量的pH 一定偏低
pH试纸直接浸入待测液,会污染溶液,A错误;氯水有强氧化性,pH试纸会被漂白,应用pH计测定氯水的pH,B错误;测定溶液pH的正确操作方法为用干燥、洁净的玻璃棒蘸取待测液滴到放在玻璃片或表面皿上的pH试纸上,显色后,与标准比色卡对照,C正确;湿润的pH试纸测量的pH不一定偏低,如用湿润的pH试纸测量氯化钠溶液的pH,测定结果不变,D错误。
5.95 ℃时,水中的c(H+)为10-6 ml·L-1,若把0.01 ml的NaOH固体溶解于95 ℃水中配成1 L溶液,则溶液的pH为A.4 B.10 C.2 D.12
95 ℃时,水中的c(H+)为10-6 ml·L-1,所以该温度下Kw是1×10-12。0.01 ml的NaOH固体溶解于95 ℃水中配成1 L溶液,溶液中OH-的浓度是0.01 ml·L-1,则溶液中c(H+)= ml·L-1=10-10 ml·L-1,因此pH=10。
6.室温下,pH=5的盐酸和pH=9的氢氧化钠溶液以体积比11∶9混合,则混合溶液的pH为A.7.2 B.8C.6 D.无法计算
pH=5的盐酸中c(H+)=1×10-5 ml·L-1,pH=9的NaOH溶液中c(OH-)=1×10-5 ml·L-1,设两溶液的体积分别为11V L和9V L,由于酸过量,所得混合溶液中c(H+)= ml·L-1=1×10-6 ml·L-1,即溶液的pH=6,C项正确。
7.已知100 ℃时,Kw=10-12,将pH=3的硫酸与pH=9的NaOH溶液混合,若要得到pH=7的溶液,混合时硫酸与NaOH溶液的体积比为A.9∶11 B.99∶101C.99∶110 D.1∶100
已知100 ℃时,Kw=10-12,则中性溶液的pH=6,pH=7说明溶液显碱性,且c(OH-)=10-5 ml·L-1,pH=3的硫酸中c(H+)=10-3 ml·L-1,pH=9的NaOH溶液中c(OH-)=10-3 ml·L-1,设加入硫酸与NaOH溶液的体积分别为V1 L、V2 L,由 =10-5 ml·L-1,解得V1∶V2=99∶101。
题组三 溶液稀释pH的变化规律8.常温下,将pH=4的硫酸分别稀释成原体积的10倍、100倍、10 000倍。则稀释后溶液的pH分别约为A.5、6、8 B.5、6、7C.4.7、6.7、8 D.4.7、6.7、7
由于稀释时存在pH强酸=a+n<7,所以将pH=4的硫酸溶液稀释10倍时,pH=5,稀释100倍时,pH=6,稀释10 000倍时pH近似等于7。
9.某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。根据图像判断下列结论错误的是A.a一定大于9B.Ⅱ为氨水稀释时溶液的pH变化曲线C.稀释后氨水中水的电离程度比NaOH 溶液中水的电离程度大D.完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀H2SO4的体 积:V(NaOH)<V(氨水)
根据题给图像可知,开始二者pH相同,在稀释过程中促进一水合氨的电离,则氨水的pH变化较小,即Ⅱ为氨水稀释时溶液的pH变化曲线,pH=11的氢氧化钠溶液稀释100倍时,pH变为9,所以pH=11的氨水稀释100倍时,pH大于9,即a一定大于9,A、B项正确;C项,稀释后氨水的pH大于NaOH溶液的pH,氨水中水的电离程度比NaOH溶液中水的电离程度小,错误;
D项,pH相同的氨水和氢氧化钠溶液,氨水的物质的量浓度大于氢氧化钠溶液的物质的量浓度,加水稀释相同的倍数,氨水的物质的量浓度仍较大,完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水),正确。
10.(2021·山西晋中高二月考)常温下,体积相同、浓度均为1.0 ml·L-1的HX溶液、HY溶液分别加水稀释,溶液的pH随稀释倍数的常用对数的变化如图所示。下列叙述正确的是A.HX是强酸,溶液每稀释10倍,pH始终增大1B.常温下HY的电离常数约为1.0×10-4C.溶液中水的电离程度:a点大于b点D.恰好中和时消耗同浓度的NaOH溶液的体积:a点大于b点
题图中1.0 ml·L-1的HX溶液的pH=0,说明HX为强酸,加水稀释,溶液pH最终接近7,溶液每稀释10倍,pH增大的值不一定始终是1,A项错误;
常温下,1.0 ml·L-1 HY溶液的pH=2.0,c(H+)=0.01 ml·L-1,则HY的电离常数Ka= ≈1.0×10-4,B项正确;
HX为强酸,HY为弱酸,加水稀释相同倍数,a点HX溶液中氢离子浓度大于b点HY溶液中氢离子浓度,故溶液中水的电离程度:a点小于b点,C项错误;
a点和b点分别为相同浓度和相同体积的HX和HY溶液分别稀释相同的倍数后所得溶液,则恰好中和时消耗同浓度的NaOH溶液的体积相同,D项错误。
11.(2022·太原高二检测)某温度下,重水(D2O)的离子积常数为1.6×10-15,若用定义pH一样规定pD=-lg c(D+),则在该温度下,下列叙述正确的是A.纯净的重水中,c(D+)·c(OD-)>1.0×10-14B.1 L溶解有0.01 ml DCl的重水溶液,其pD=2C.1 L溶解有0.01 ml NaOD的重水溶液,其pD=12D.纯净的重水中,pD=7
A项,该温度下重水(D2O)的离子积常数为1.6×10-15<1.0×10-14,错误;
12.现有常温时pH=1的某强酸溶液10 mL,下列操作能使溶液的pH变成2的是A.加水稀释成100 mLB.加入10 mL 0.01 ml·L-1的NaOH溶液C.加入10 mL的水进行稀释D.加入10 mL 0.01 ml·L-1的HCl溶液
13.pH=2的X、Y、Z三种酸的溶液各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积(V)的变化关系如图所示,下列说法错误的是 A.X是强酸,Y和Z是弱酸B.稀释前的浓度:c(Z)>c(Y)>c(X)C.稀释前电离程度:X>Y>ZD.pH=2时,X、Y、Z的溶液都是稀溶液
pH=2的酸溶液稀释1 000倍后,如果是强酸,则稀释后溶液的pH=5,如果是弱酸,稀释后溶液的pH<5,根据图像可知,X是强酸、Y和Z属于弱酸,A项正确;
pH相等时,弱酸的浓度大于强酸的浓度,所以Y和Z的浓度大于X的浓度,根据图像可知,刚开始稀释时,Z的pH减小,Y的pH增大,说明Z是浓溶液,Y是稀溶液,则三种酸的浓度:c(Z)>c(Y)>c(X),B项正确、D项错误;
强电解质X完全电离,Y和Z部分电离,弱电解质溶液浓度越大其电离程度越小,所以稀释前电离程度:X>Y>Z,C项正确。
14.现有常温下的六份溶液:①0.01 ml·L-1 CH3COOH溶液②0.01 ml·L-1盐酸③pH=12的氨水④pH=12的NaOH溶液⑤0.01 ml·L-1 CH3COOH溶液与pH=12的氨水等体积混合后所得溶液⑥0.01 ml·L-1盐酸与pH=12的NaOH溶液等体积混合后所得溶液
(1)其中水的电离程度最大的是 (填序号,下同),水的电离程度相同的是 。
酸和碱都会抑制水的电离,⑥为NaCl溶液,对H2O的电离无抑制作用,②③④对水的电离抑制程度相同。
(2)若将②③混合后所得溶液pH=7,则消耗溶液的体积② (填“>”“<”或“=”,下同)③。
因pH=12的氨水中c(NH3·H2O)>0.01 ml·L-1,故②③混合,欲使pH=7,则所需溶液体积:②>③。
(3)将六份溶液同等稀释10倍后,溶液的pH:① ②,③ ④,⑤ ⑥。
15.(1)在某温度下,水的离子积常数为1×10-13,则该温度下:①某溶液中的H+浓度为1×10-7 ml·L-1,则该溶液显 性。
某溶液中的H+浓度为1×10-7 ml·L-1,则该溶液中c(OH-)= ml·L-1=1×10-6 ml·L-1>c(H+),即该溶液显碱性。
②99 mL pH=1的H2SO4溶液与101 mL pH=12的KOH溶液混合(不考虑混合时溶液体积的变化),溶液的pH= 。
(2)现有①醋酸溶液、②盐酸、③硫酸,回答下列问题:a.若三种溶液的pH相同,则其浓度由大到小的顺序是 (用序号表示,下同)。
pH相同的溶液中氢离子浓度相同,醋酸是一元弱酸,硫酸是二元强酸、盐酸是一元强酸,假设氢离子浓度为1 ml·L-1,则醋酸溶液浓度大于1 ml·L-1、盐酸浓度是1 ml·L-1、硫酸浓度是0.5 ml·L-1,所以其浓度由大到小的顺序是①>②>③。
b.若三种溶液的浓度相同,则pH由大到小的顺序是 。
若三种溶液的浓度相同,假设都是1 ml·L-1,醋酸溶液中氢离子浓度小于1 ml·L-1、硫酸中氢离子浓度是2 ml·L-1、盐酸中氢离子浓度是1 ml·L-1,氢离子浓度越大pH越小,所以pH由大到小的顺序是①>②>③。
c.中和等体积相同浓度的烧碱溶液,需同浓度的三种溶液的体积分别为V1、V2、V3,则V1、V2、V3的关系为 (用等式表示,下同)。
中和等物质的量的氢氧化钠,消耗三种酸的物质的量之比为2∶2∶1,所以消耗同浓度的三种溶液的体积之比为2∶2∶1,即V1=V2=2V3。
d.体积和浓度均相同的三种溶液,分别与同浓度的烧碱溶液恰好完全反应,需烧碱溶液的体积分别为V1、V2、V3,则V1、V2、V3的关系为 。
体积和浓度均相同的三种溶液,其物质的量相等,分别与同浓度的烧碱溶液恰好完全反应,所需NaOH的物质的量之比为1∶1∶2,则所需同浓度烧碱溶液的体积关系为2V1=2V2=V3。
苏教版 (2019)选择性必修1第二单元 溶液的酸碱性获奖ppt课件: 这是一份苏教版 (2019)选择性必修1第二单元 溶液的酸碱性获奖ppt课件,共16页。PPT课件主要包含了学习目标,水的电离离子积,水的电离,nH2O=,556mol,3加入碱,2加入酸,醋酸溶液,OH-,酸电离的+水电离的等内容,欢迎下载使用。
高中化学专题3 水溶液中的离子反应第二单元 溶液的酸碱性完美版ppt课件: 这是一份高中化学专题3 水溶液中的离子反应第二单元 溶液的酸碱性完美版ppt课件,共32页。PPT课件主要包含了-lgnc,+lgnc,③碱过量,深度思考,或12,∶11,×10-12,方法指导等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第二单元 溶液的酸碱性教学演示ppt课件: 这是一份苏教版 (2019)选择性必修1第二单元 溶液的酸碱性教学演示ppt课件,共60页。PPT课件主要包含了课时对点练,溶液的酸碱性与pH,×10-7,×10-12,-lgcH+,玻璃片或表面皿上,标准比色卡,正误判断,归纳总结,应用体验等内容,欢迎下载使用。













