




高中苏教版 (2019)第二单元 化学能与电能的转化优秀ppt课件
展开1.以电解熔融NaCl探究电解的工作原理,理解电解池中电子的移动、阴阳离子的移动、阴阳两极上的反应及其变化、电流形成的过程和原理。2.以CuCl2溶液的电解为模型掌握电解池的构成,阴、阳极放电顺序、电解方程式书写、现象分析、计算。
莫瓦桑电解制氟仪器装置图(1886年)
自从1807年戴维首次使用电解方法制得金属钾,之后的研究继续用电解法获得了钠、钙、镁、钡、锶、硼、硅、铝、氟等单质。电解为这些元素的发现立下了汗马功劳。
在工业生产和日常生活中,人们常常需要通过电解的方法使许多不能自发进行的反应顺利进行。
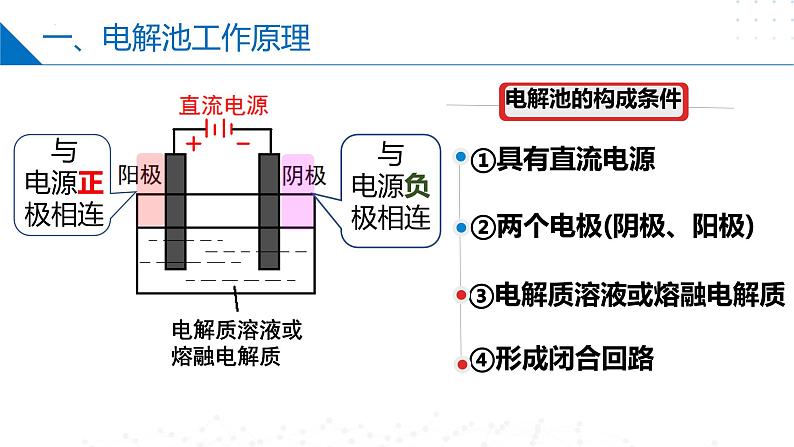
将电能转化为化学能的装置(也称电解槽)。
在直流电的作用下,在两极上分别发生氧化反应和还原反应的过程。
电解质溶液或熔融电解质
②两个电极(阴极、阳极)
③电解质溶液或熔融电解质
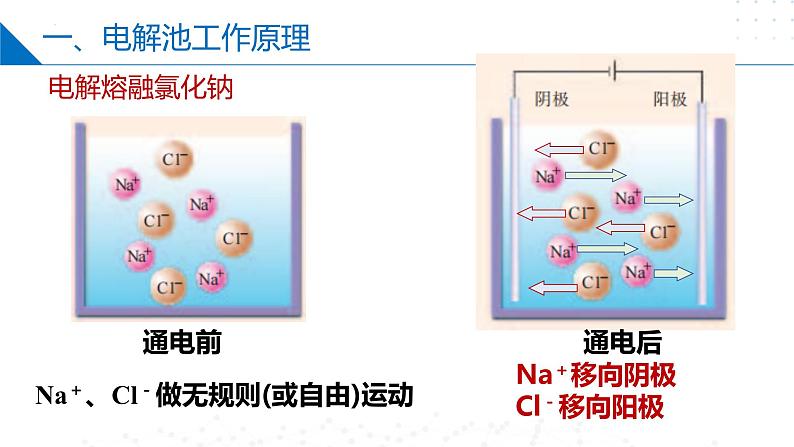
Na+、Cl-做无规则(或自由)运动
Na+移向阴极Cl-移向阳极
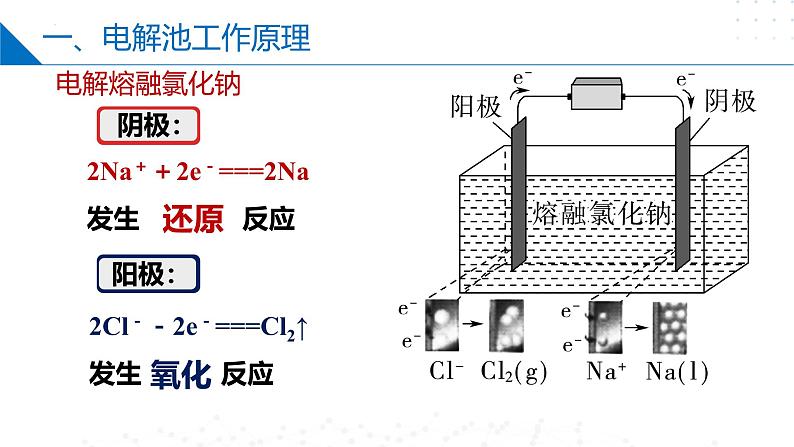
2Cl--2e-===Cl2↑发生 反应
2Na++2e-===2Na发生 反应
工业上活泼金属的制备通常用电解法。
MgCl2(熔融) MgAl2O3(熔融) Al
阳离子移向电解池的阴极;阴离子移向电解池的阳极。
从电源负极流向电解池的阴极,从电解池的阳极流向电源的正极。
阴(极)得(e-)阳(极)失(e-)
电解时必须使用直流电源,不能使用交流电源。
电解质的水溶液或熔融电解质均可被电解,因为它们均可电离出自由移动的阴、阳离子。
电解过程中,电能转化为化学能而储存在电解产物中,转化过程中遵循能量守恒定律。
电解质溶液(或熔融电解质)的导电过程,就是电解质溶液(或熔融电解质)的电解过程,是化学变化,而金属的导电是利用其物理性质。
电解法是一种强氧化还原手段,可以完成非自发的氧化还原反应。
原电池中:阳离子→正极;阴离子→负极;电解池中:阳离子→阴极;阴离子→阳极;二者的阳离子都是移向发生还原反应的电极,阴离子都是移向发生氧化反应的电极。
阴、阳离子在电解过程中的移动方向与在原电池中的移动方向有什么区别和联系?
CuCl2 == Cu2+ + 2Cl-
H2O H+ + OH-
2Cl--2e-==Cl2↑
Cu2++2e-==Cu
无论是惰性电极还是活泼电极都不参与电极反应,发生反应的是溶液中的阳离子。
阳离子放电顺序:Ag+>Cu2+>H+>Pb2+>Fe2+>Zn2+……
阴极发生还原反应,氧化性强的粒子优先放电
Ag+>Cu2+>H+>Pb2+>Fe2+>Zn2+……
溶液中还原性强的阴离子失去电子被氧化,或者电极材料本身失去电子被氧化而溶入溶液中。
其放电顺序:活泼金属阳极>S2->I->Cl->OH->含氧酸根。
阳极发生氧化反应,还原性强的粒子优先放电
活泼金属阳极>S2->I->Cl->OH->含氧酸根。
如何判断电解池阴、阳极?
如何判断电解时电极产物?
惰性电极为铂、金、石墨电极,活性电极(除铂、金、石墨电极之外的电极)在阳极时优先放电。
用惰性电极电解酸、碱、盐溶液
H+ 、OH-、SO42-
H+ 、OH-、Na+
Na+ 、SO42- 、H+ 、OH-
OH->SO42-
4OH--4e-===O2↑+2H2O
4H++4e-===2H2↑
H+ 、Cl- 、OH-
Cu2+ 、Cl- 、H+ 、OH-
Cl- > OH-
2Cl--2e-===Cl2↑
2H++2e-===H2↑
Cu2++2e-===Cu
Na+ 、Cl- 、H+ 、OH-
Cu2+ 、SO42- 、H+ 、OH-
加入CuO或CuCO3
若阴极为H+放电,则阴极区c(OH-)增大;若阳极为OH-放电,则阳极区c(H+)增大;若阴极为H+放电,同时阳极为OH-放电,相当于电解水,电解质溶液浓度增大(饱和溶液例外)。
电解质溶液恢复原状的方法:少什么加什么,少多少加多少。如用惰性电极电解CuSO4溶液,加入适量CuO可恢复到电解前的状况而不能加入Cu(OH)2。
书写电解池中电极反应式时,强电解质以实际放电的离子表示,弱电解质写成化学式,总反应注明条件“通电”。
电极反应式的书写首先根据题干要求及信息写出反应物和生成物,然后根据“阴(极)得(e-)阳(极)失(e-)”加上得失电子数目,最后根据电解质溶液酸碱性补上H+、OH-或H2O,依据电荷守恒配平。酸性溶液中不能出现OH-,碱性溶液中不能出现H+。
从H+、Cu2+、Na+、SO42- 、Cl-5种离子中两两恰当的组成电解质,按下列要求进行电解:(1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则采用的电解质是____________。若要恢复到电解前的状态,应加入的物质是____________。(2)以碳棒为电极,电解过程中电解质质量不变,水量减少,则采用的电解质是_________________。若要恢复到电解前的状态,应加入的物质是__________。(3)以碳棒为阳极,铁棒为阴极,电解过程中电解质和水量都减少,则电解质是___________________。若要恢复到电解前的状态,应加入的物质是_________________。
CuO(或CuCO3)、HCl
Na2SO4、H2SO4
CuSO4、NaCl
电解NaCl电解CuCl2
电极反应规律用惰性电极电解酸、碱、盐溶液
1、如图所示的两个电解槽中,A、B、C、D均为石墨电极。如果电解过程中共有0.02 ml电子通过,下列叙述正确的是( )A.甲电解槽中A极最多可析出0.64 g铜B.甲电解槽中B极的电极反应式为2H2O-4e-=O2↑+4H+C.乙电解槽中滴入酚酞溶液,D极附近溶液变红D.乙电解槽中C极的电极反应式为2H2O+2e-===H2↑+2OH-
高中化学苏教版 (2019)选择性必修1专题1 化学反应与能量第二单元 化学能与电能的转化评优课ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009311_t3/?tag_id=26" target="_blank">专题1 化学反应与能量第二单元 化学能与电能的转化评优课ppt课件</a>,文件包含121化学能与电能的转化原电池的工作原理同步课件-2023-2024学年高二化学同步精品课堂苏教版2019选择性必修第一册pptx、1伏打电池_原电池的化学发明史mp4等2份课件配套教学资源,其中PPT共32页, 欢迎下载使用。
沪科技版(2020)选择性必修1电解池的工作原理获奖ppt课件: 这是一份沪科技版(2020)选择性必修1<a href="/hx/tb_c4036464_t3/?tag_id=26" target="_blank">电解池的工作原理获奖ppt课件</a>,文件包含431电解池电解池的工作原理同步课件pptx、01-氯化铜溶液的电解mp4等2份课件配套教学资源,其中PPT共31页, 欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化教案配套ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009311_t3/?tag_id=26" target="_blank">第二单元 化学能与电能的转化教案配套ppt课件</a>,共1页。













