



2020-2021学年第二单元 化学能与电能的转化图文课件ppt
展开(2)活动性不同的两导体作电极: ①活动性不同的金属或非金属导体(如石墨) ②两相同的导体(如Pt黑)但吸附有不同的物质 导致其活动性不同
(1)有能自发进行的氧化还原反应
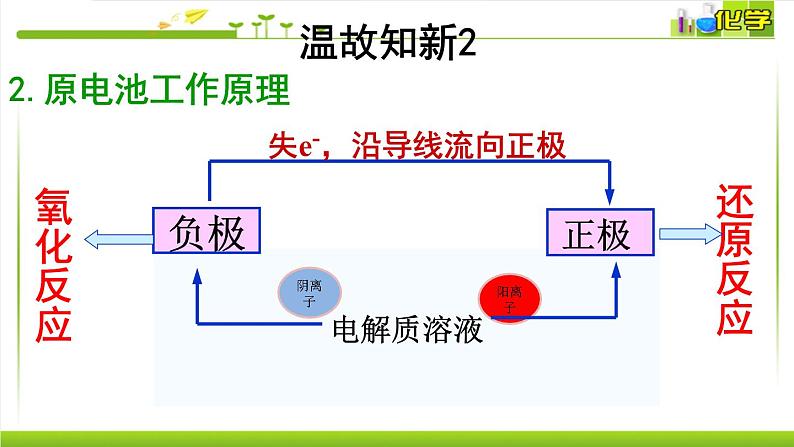
失e-,沿导线流向正极
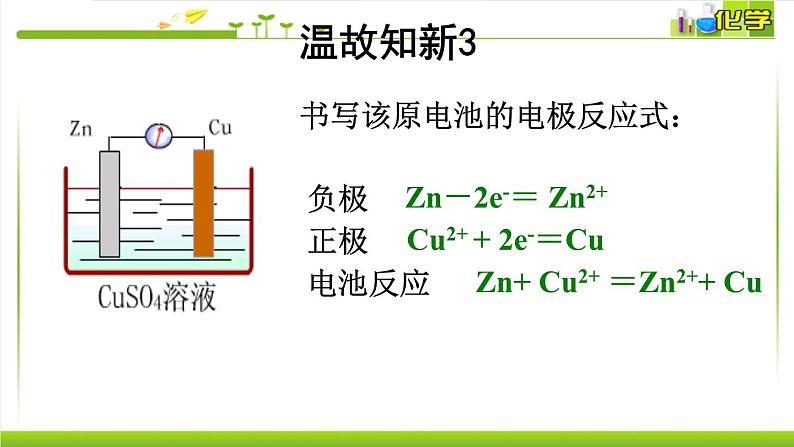
书写该原电池的电极反应式:
Zn-2e-= Zn2+
Cu2+ + 2e-=Cu
Zn+ Cu2+ =Zn2++ Cu
该原电池在工作中有何缺点?
电极材料与电解质溶液接触,即没有将氧化剂与还原剂分开,不易控制
工作时,锌片也和硫酸铜反应,生成铜单质,原电池的电动势很快降低,电压不稳定
将氧化剂和还原剂分开,锌片与硫酸铜不直接接触
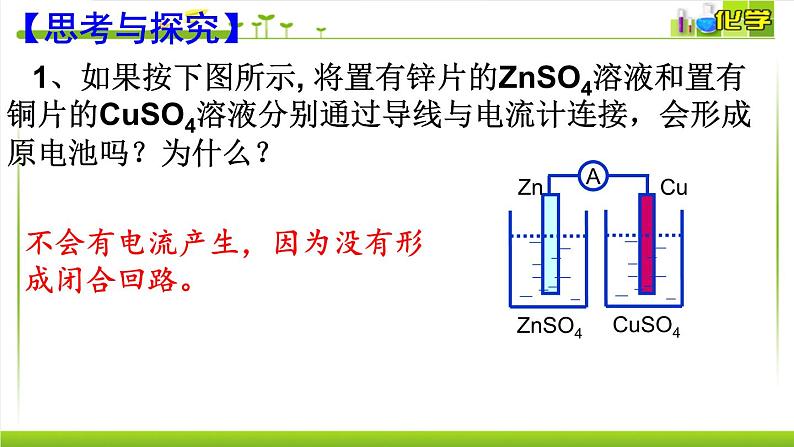
1、如果按下图所示, 将置有锌片的ZnSO4溶液和置有铜片的CuSO4溶液分别通过导线与电流计连接,会形成原电池吗?为什么?
不会有电流产生,因为没有形成闭合回路。
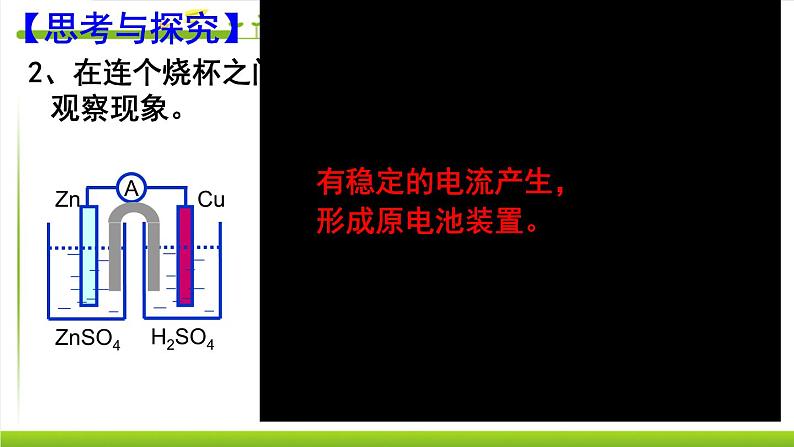
2、在连个烧杯之间加一个联通装置,观察现象。
有稳定的电流产生,形成原电池装置。
联通两个烧杯的装置,叫做盐桥。(含琼胶的KCl饱和溶液)
1、导电,形成闭合回路。2、提供离子,平衡电荷。
注意:若撤去盐桥或将盐桥换成导线,则不能构成闭合回路。
阳离子→正极阴离子→负极
二、原电池原理的应用:
(1)比较金属的活动性强弱
例1:下列叙述中,可以说明金属甲比金属乙活泼性强的是( )
C.用甲、乙作电极组成原电池时,甲作负极
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2放出
B.在氧化还原反应中,甲比乙失去的电子多
D.同价态的阳离子,甲比乙的氧化性强
例2:下列制取氢气的反应中反应速率最快的是( )
C.粗锌和1 ml/L 盐酸
A.纯锌和1 ml/L 硫酸
B.纯锌和18 ml/L 硫酸
D.粗锌和1 ml/L 硫酸的反应中加入几滴CuSO4溶液
(2)加快反应的速率
例:Fe+ Cu2+ = Fe2+ + Cu为依据。
①将氧化还原反应拆成氧化反应和还原反应两个半反应,分别作原电池的负极和正极的电极反应式
负极:Fe-2e-====Fe2+
正极:Cu2+ +2e-==Cu
先确定负极材料,负极材料一般是对应的金属单质。然后再确定正极材料。正极材料没有负极活泼。
电解质溶液一般要能够与负极发生反应。
依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:(1)电极X的材料是________;电解质溶液Y是___________;(2)银电极为电池的________极,发生的电极反应为_________________X电极上发生的电极反应为____________________________;(3)外电路中的电子是从_______电极流向________电极。
Ag++e- = Ag
Cu -2e- = Cu2+
利用下列反应 Cu+2Fe3+=Cu2+ +2Fe2+,设计原电池。⑴画出此原电池的装置简图;⑵注明原电池的正负极;⑶注明外电路中电子的流向;⑷写出电极反应式。
判断下列原电池的正、负极,并写出电极反应式和电池反应式。
1、越活泼的金属一定作负极吗? 2、归纳电极反应式的书写方法
负极:2Al+8OH--6e-==2AlO2-+4H2O 正极:6H2O+6e-==6OH- +3H2↑总反应:2Al+2OH-+2H2O==2AlO2-+3H2↑
负极: Mg-2e-==Mg2+ 正极: 2H++2e-==H2↑总反应:Mg+2H+==Mg2++H2↑
化学选择性必修1第一节 原电池精品ppt课件: 这是一份化学选择性必修1<a href="/hx/tb_c4002434_t3/?tag_id=26" target="_blank">第一节 原电池精品ppt课件</a>,文件包含41原电池ppt、实验4-1锌铜原电池实验mp4、实验活动4简单的电镀实验mp4、实验活动5制作简单的燃料电池mp4等4份课件配套教学资源,其中PPT共40页, 欢迎下载使用。
高中化学第二单元 化学能与电能的转化公开课课件ppt: 这是一份高中化学第二单元 化学能与电能的转化公开课课件ppt,共31页。PPT课件主要包含了化学能与电能的转化,主要内容,主要特点,学习方法,两极一液一连线,习题探究,作业布置等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 原电池完整版ppt课件: 这是一份人教版 (2019)选择性必修1第一节 原电池完整版ppt课件,文件包含人教版高中化学选择性必修一411原电池的工作原理课件pptx、人教版高中化学选择性必修一411原电池的工作原理学案docx等2份课件配套教学资源,其中PPT共38页, 欢迎下载使用。













