



苏教版 (2019)选择性必修1第二单元 化学能与电能的转化试讲课课件ppt
展开1.证据推理与模型认知:了解常见的一次电池、二次电池、燃料电池的原理,优点及质量优劣的评价。2.变化观念与平衡思想:掌握新型化学电源的工作原理、电极反应、分析现象及相关计算。
化学电源按其反应原理分类:
普通锌锰电池、碱性锌锰电池、纽扣式银锌电池
又称为充电电池或蓄电池,铅蓄电池、镍镉电池、镍氢电池、银锌电池、锂电池和锂离子电池。
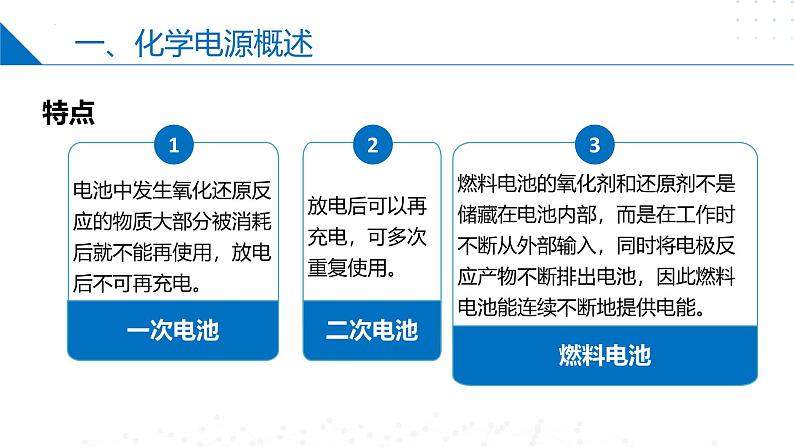
电池中发生氧化还原反应的物质大部分被消耗后就不能再使用,放电后不可再充电。
放电后可以再充电,可多次重复使用。
燃料电池的氧化剂和还原剂不是储藏在电池内部,而是在工作时不断从外部输入,同时将电极反应产物不断排出电池,因此燃料电池能连续不断地提供电能。
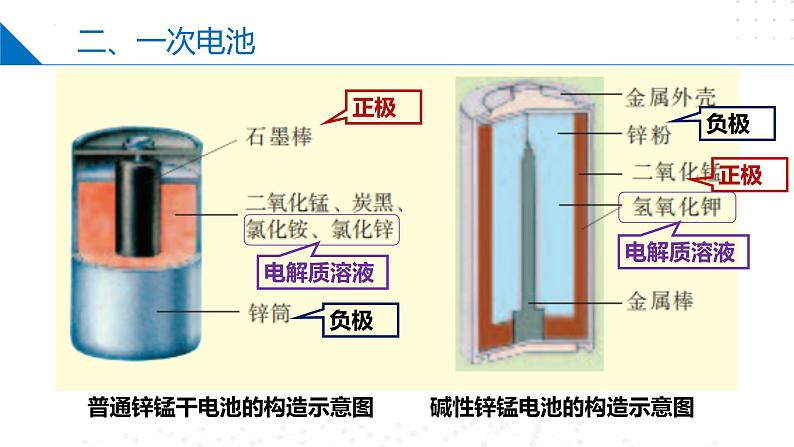
普通锌锰干电池的构造示意图
碱性锌锰电池的构造示意图
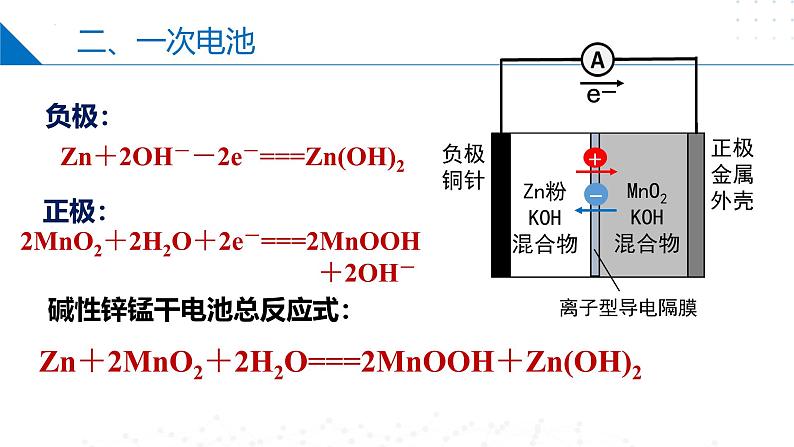
碱性锌锰干电池总反应式:
Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2
Zn+2OH--2e-===Zn(OH)2
2MnO2+2H2O+2e-===2MnOOH +2OH-
纽扣式银锌电池的构造示意图
Ag2O+H2O+2e-===2Ag+2OH-
总反应式:Zn+Ag2O+H2O===Zn(OH)2+2Ag
二次电池又称为充电电池或蓄电池,放电后可以再充电使活性物质获得再生,因此二次电池可以多次重复使用。铅蓄电池是最常见的二次电池。
铅酸蓄电池的构造示意图
铅蓄电池优点电压稳定使用方便安全可靠价格低廉
铅蓄电池的电极反应物(Pb、PbO2)和放电后的产物(PbSO4)均以固体形式附着在电极材料表面。
目的:使电极反应物和产物富集在电极材料表面,充、放电时可以循环转化,实现电池重复使用。
Pb+SO4 2--2e-=PbSO4
PbO2+SO42-+4H++2e- =PbSO4+ 2H2O
放电过程中,负极质量的变化是 ,电解质溶液pH的变化是 。
阴极(发生还原反应):
PbSO4+2e-===Pb+SO42-
PbSO4+2H2O-2e-===PbO2+4H++SO42-
充电时,铅蓄电池阳极与直流电源正极相连,阴极与直流电源负极相连。
随着信息技术的发展,为了适应移动通信、便携式电脑和各种电子产品等的广泛使用,科研工作者不断研制出小型化、高比能量、工作寿命长、不需要特殊维护的二次电池。目前已开发出镍镉电池、镍氢电池、银锌电池、锂电池和锂离子电池等新型二次电池。
MH-e- +OH-=M+H2O
NiO(OH)+e- =NiO+OH-
放电时:Li+由石墨中脱嵌移向正极,嵌入钴酸锂晶体中;充电时:Li+从钴酸锂晶体中脱嵌,由正极回到负极,得到电子生成Li重新嵌入石墨中
嵌锂石墨(LixC6)
磷酸铁锂(LiFePO4)或钴酸锂(LiCO2)
锂离子的载体,如六氟磷酸锂(LiPF6)的碳酸酯无水溶液
锂离子电池的工作原理示意图
电池总反应:LixC6+Li(1-x)CO2=LiCO2+6C
以钴酸锂-石墨锂电池为例
Li(1-x)CO2+xLi++xe-=LiCO2
LixC6-xe-=6C+xLi+
例1 铅蓄电池是一种典型的可充电电池,其放电时的电池总反应式为Pb+PbO2+4H++2SO 2PbSO4+2H2O,则下列说法正确的是( ) A.电池工作时,负极反应为Pb-2e-===Pb2+B.铅蓄电池是二次电池,放电时电能转化为化学能C.铅蓄电池放电时两个电极质量都增大D.铅蓄电池充电时阳极电极反应为PbSO4+2H2O+2e-=PbO2+4H++SO
燃料电池是利用燃料和氧化剂之间发生的氧化还原反应,将化学能直接转化为电能的化学电池。燃料电池的氧化剂和还原剂不是储藏在电池内部,而是在工作时不断从外部输入,同时将电极反应产物不断排出电池,因此燃料电池能连续不断地提供电能。
2022北京冬奥会氢能源用车
氢氧燃料电池(碱性介质)
电解质溶液:氢氧化钾溶液
电池总反应: 2H2 + O2 = 2H2O
2H2-4e-+4OH-===4H2O
O2+2H2O+4e-===4OH-
碱性溶液电极反应式不能出现H+
2H2 - 4e- === 4H+
O2 + 4H+ + 4e- === 2H2O
氢氧燃料电池(酸性介质)
电池总反应: 2H2 + O2 =2 H2O
酸性溶液电极反应式不能出现OH-
2O2+4H2O+8e-===8OH-
CH4+10OH--8e-===CO32-+7H2O
2O2+8H++8e-===4H2O
CH4-8e-+2H2O===CO2+8H+
总反应:N2H4+O2===N2+2H2O
正极:O2+2H2O+4e-===4OH-
负极:N2H4+4OH--4e-===N2+4H2O
例2 有一种瓦斯分析仪(如图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中固体电解质是Y2O3-Na2O,O2- 可以在其中自由移动。下列说法正确的是( )A.瓦斯分析仪工作时,电池外电路中电流由电极a流向电极bB.电极b是正极,O2-由电极a流向电极bC.电极a的反应式为CH4+5O2--8e-===CO +2H2OD.当固体电解质中有1 ml O2-通过时,转移电子2 ml
氢氧燃料电池甲烷燃料电池肼燃料电池
1、 如图,某液态金属储能电池放电时产生金属化合物Li3Bi。下列说法正确的是( )A.放电时,M电极反应为Ni-2e-===Ni2+B.放电时,Li+由M电极向N电极移动C.充电时,M电极的质量减小D.充电时,N电极反应为Li3Bi+3e-===3Li++Bi
2、某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以CH4、CH3OH为燃料时,该电池工作原理如图。下列说法正确的是( )A.a为CH4或CH3OH,b为CO2B.Y电极的电极反应式为O2+2CO2+4e-===2COC.电池工作时,熔融碳酸盐只起到导电的作用D.CO 向正极移动
高中化学沪科技版(2020)选择性必修1化学电源——电池精品ppt课件: 这是一份高中化学沪科技版(2020)选择性必修1<a href="/hx/tb_c4036462_t3/?tag_id=26" target="_blank">化学电源——电池精品ppt课件</a>,共31页。PPT课件主要包含了学习目标,化学电源概述,干电池,铅酸蓄电池,锂离子电池,氢燃料电池,甲醇燃料电池,各种电池特性,课堂小结等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第二节 化学电源教案配套ppt课件: 这是一份人教版 (新课标)选修4 化学反应原理<a href="/hx/tb_c22177_t3/?tag_id=26" target="_blank">第二节 化学电源教案配套ppt课件</a>,共25页。PPT课件主要包含了情境引入,知识回顾,自发的氧化还原反应,闭合回路,原电池,化学能,离子导体,电极材料,电极反应,电子导体等内容,欢迎下载使用。
高中苏教版 (2019)专题1 化学反应与能量第二单元 化学能与电能的转化授课ppt课件: 这是一份高中苏教版 (2019)<a href="/hx/tb_c4009311_t3/?tag_id=26" target="_blank">专题1 化学反应与能量第二单元 化学能与电能的转化授课ppt课件</a>,共1页。













