




高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化示范课课件ppt
展开专题1 化学反应与能量变化第二单元 化学能与电能的转化
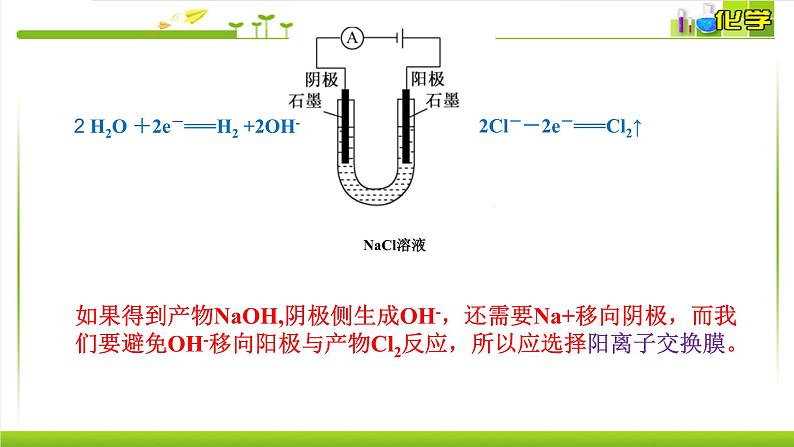
电极反应式:阳极: 阴极: 总反应方程式:
2 H2O +2e-===H2 +2OH-
2Cl--2e-===Cl2↑
思考:工业电解饱和食盐水存在什么隐患?
(2)避免生成物H2和Cl2混合,混合后遇火或遇强光爆炸.
(1)避免Cl2接触NaOH溶液会反应,使产品不纯。反应方程式: .
Cl2 +2 NaOH =NaCl + NaClO + H2O
解决方法:使用离子交换膜
电解饱和食盐水必须解决两个主要问题:
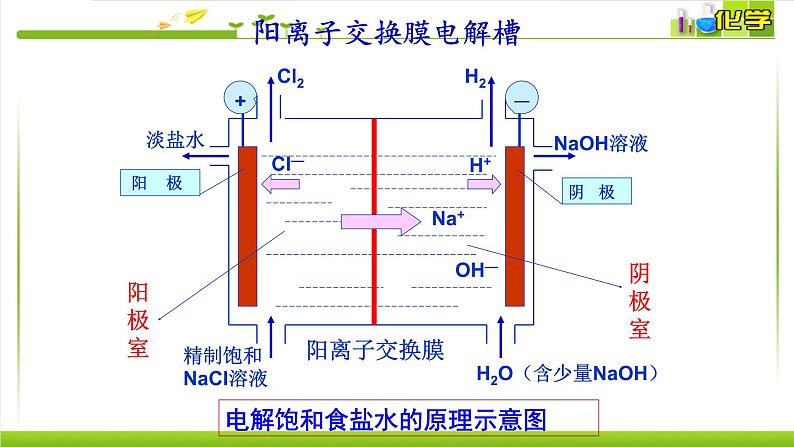
如果得到产物NaOH,阴极侧生成OH-,还需要Na+移向阴极,而我们要避免OH-移向阳极与产物Cl2反应,所以应选择阳离子交换膜。
H2O(含少量NaOH)
电解饱和食盐水的原理示意图
⑴概念: 应用电解原理在某些金属表面镀上一层其它金属或合金的过程。
⑵电镀的目的:增强金属抗腐蚀能力,增加美观和硬度。
思考:如果想在铁制品上镀上铜,该如何设计实验?
1.铁制品应该在哪一极?2.电解质溶液中应该含有什么离子?3.另一极应该用什么材料做电极?
Cu2++2e-=Cu
Cu-2e-=Cu2+
电解一段时间后溶液中硫酸铜浓度怎样变化?
③电解液-含镀层金属阳离子的盐溶液
电镀液的组成及酸碱性保持不变
Zn、Fe、Ni、Ag、Au等
阳极--粗铜阴极--纯铜电解液-- CuSO4溶液
Zn -2e-=Zn2+
Fe-2e-=Fe2+
Ni -2e-=Ni2+
Cu-2e-=Cu2+
Au、Ag---阳极泥
阴极: Cu2+ +2e-=Cu
思考:精炼铜时,电解液中的Cu2+浓度是否会发生改变?
用电解精炼法所得到的铜叫做电解铜,它的纯度很高,可以达到99.95%~99.98%。
电解精炼池、电镀池的比较
应用电解原理在某些金属表面镀上一层其它金属的装置。
①镀层金属接电源正极,待镀金属接电源负极②电镀液须含有镀层金属的离子
阳极:镀层金属;阴极:镀件
应用电解原理将不纯的金属提纯的装置。
①不纯金属接电源正极纯的金属接电源负极②电解质溶液须待提纯金属的离子
阳极:不纯金属;阴极:纯金属
四、电冶金(冶炼活泼金属钠、钾、钙、镁、铝等)
电解熔融状态的氯化钠。
2Cl - -2e- == Cl2↑
2Na+ + 2e- == 2Na
电解熔融状态的氧化铝。
6O 2- -12e- == 3 O2↑
4Al3+ + 12e- == 4Al
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)阳极材料(碳)和熔融氧化铝需要定期补充
2H2O-4e-═4H++O2↑
Cu2++2e-=Cu
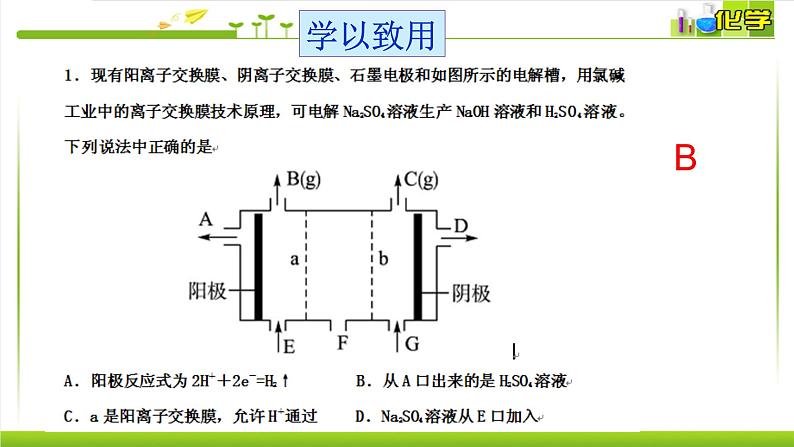
电极 A B C D产物 Ag O2 Cu Cl2物质的量之比4 1 2 2
高中化学第四章 化学反应与电能第二节 电解池完整版ppt课件: 这是一份高中化学第四章 化学反应与电能第二节 电解池完整版ppt课件,文件包含人教版高中化学选择性必修一422电解原理的应用课件pptx、人教版高中化学选择性必修一422电解原理的应用学案docx等2份课件配套教学资源,其中PPT共31页, 欢迎下载使用。
化学选择性必修1第二节 电解池优秀课件ppt: 这是一份化学选择性必修1第二节 电解池优秀课件ppt,共20页。PPT课件主要包含了电解原理等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化图片ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化图片ppt课件,共14页。PPT课件主要包含了学习目标,交流讨论,Cl2,Cl-,Na+,NaCl,OH-,课堂探究,硫酸酸化的硫酸铜,Cu2+等内容,欢迎下载使用。













