


高中化学苏教版 (2019)选择性必修1专题1 化学反应与能量第二单元 化学能与电能的转化评优课ppt课件
展开1.通过以锌铜原电池为例,从宏观和微观的角度,分析理解原电池的工作原理,能正确判断原电池的正极和负极,会书写其电极反应式,培养宏观辨识与微观探析的化学核心素养。2.通过进一步理解化学能与电能的相互转化,认识从简单原电池发展到带有盐桥原电池的过程变化,并能理解带有盐桥原电池的实用性,培养变化观念与平衡思想的化学核心素养。
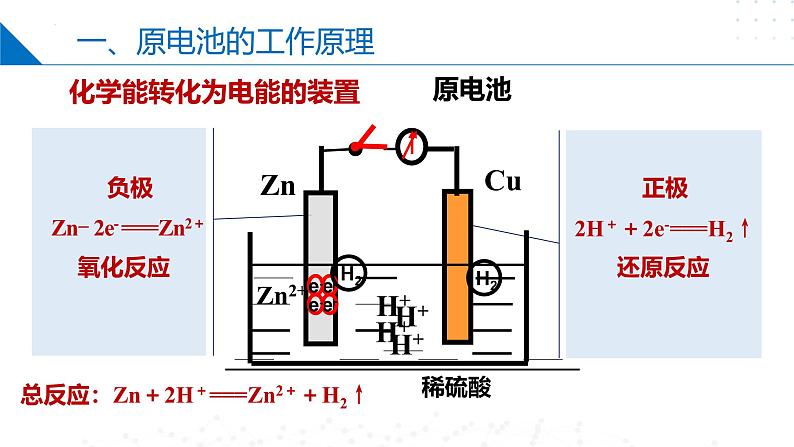
2H++2e-===H2↑
总反应:Zn+2H+===Zn2++H2↑
Zn- 2e- ===Zn2+
化学能转化为电能的装置
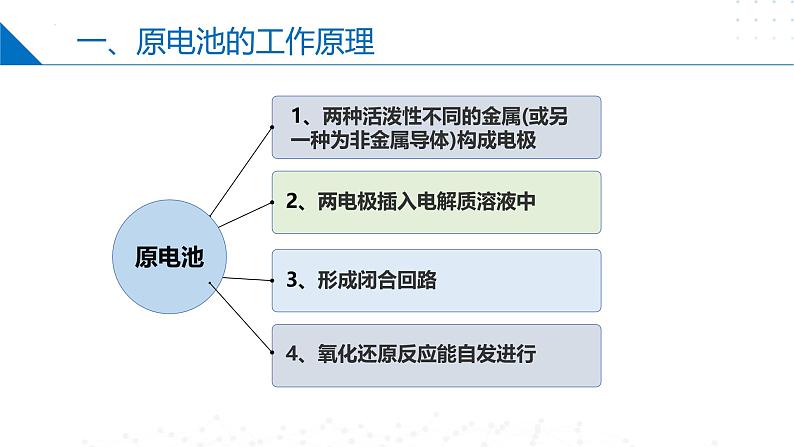
4、氧化还原反应能自发进行
2、两电极插入电解质溶液中
1、两种活泼性不同的金属(或另一种为非金属导体)构成电极
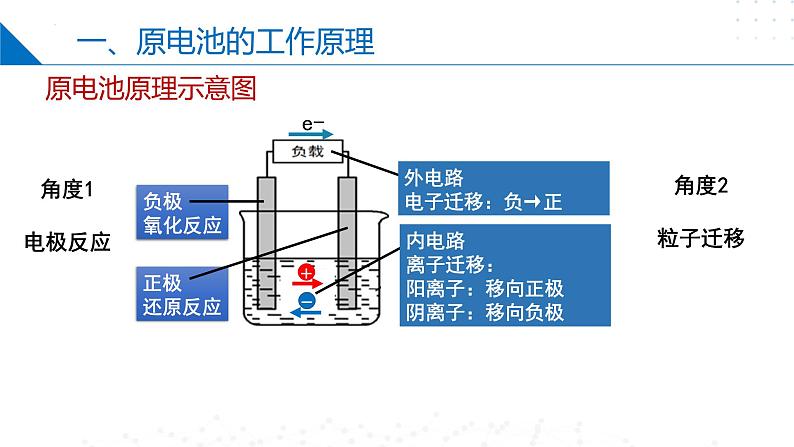
外电路电子迁移:负→正
内电路离子迁移:阳离子:移向正极阴离子:移向负极
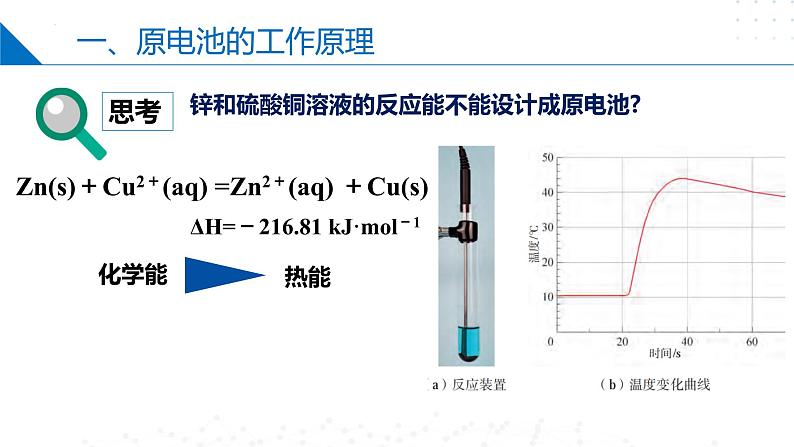
Zn(s)+Cu2+(aq) =Zn2+(aq) +Cu(s)
化学能
锌和硫酸铜溶液的反应能不能设计成原电池?
ΔH=-216.81 kJ·ml-1
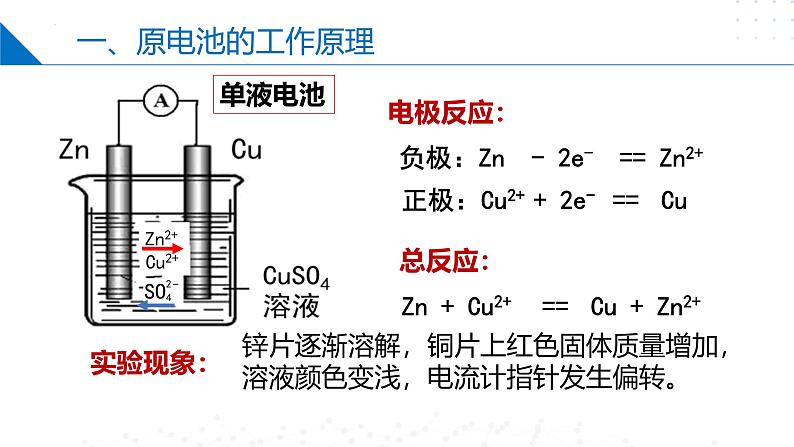
Zn + Cu2+ == Cu + Zn2+
负极:Zn - 2e- == Zn2+
正极:Cu2+ + 2e- == Cu
锌片逐渐溶解,铜片上红色固体质量增加,溶液颜色变浅,电流计指针发生偏转。
观察并记录实验现象,其中哪些与预测一致,哪些与预测不同?
相同:铜片表面附着红色固体,电流表指针偏转。
不同:锌片表面附着红色固体电流逐渐衰减
两个溶液间缺少离子导体,无法形成闭合回路。
盐桥中通常装有含KCl饱和溶液的琼胶, K+和Cl-可在其中自由移动。
③避免电极与电解质溶液直接反应,相比单液原电池有利于最大程度地将化学能转化为电能。
②平衡两侧溶液的电荷,使溶液保持电中性。
如何判断原电池中的正、负极?
例1 有关下图装置的说法中正确的是( )A.电流从铜经过导线流向石墨B.盐桥中的K+移向石墨电极C.乙池中电极反应式为NO +4H++e-===NO2↑+2H2OD.当铜棒质量减少6.4 g时,甲池溶液质量增加6.4 g
电极反应式遵循质量守恒、得失电子守恒及电荷守恒,遵循离子方程式的书写规则,两电极反应式相加得电池总化学(或离子)方程式。
一般电极反应式的书写方法
1、书写电极反应式的原则
二、原电池电极反应式书写
2、一般电极反应式的书写方法
电极产物在电解质溶液中应能稳定存在,如碱性介质中生成的H+应让其结合OH-生成水。电极反应式要依据电荷守恒和质量守恒、得失电子守恒等加以配平。
按照负极发生氧化反应,正极发生还原反应,判断出电极反应产物,找出得失电子的数量。
电极反应式要依据电荷守恒和质量守恒、得失电子守恒等加以配平。复杂电极反应式=总反应式-简单的电极反应式。
将两电极反应式相加(注意两极得失电子数相等)可得电池总反应式。
3.书写电极反应式的基本类型(1)类型一 题目给定原电池的装置图,未给总反应式
遵循氧化还原反应离子方程式的配平原则,写出电极反应式。
结合电解质判断出还原产物和氧化产物。
首先找出原电池的正、负极,即分别找出氧化剂和还原剂。
例2 (1)甲装置中正极为________,电极反应式为__________________,负极为__________,电极反应式为________________。
(2)乙装置中正极为_____,电极反应式为__________________,负极为______,电极反应式为________________________。
2H++2e-===H2↑
Mg-2e-===Mg2+
6H2O+6e-===3H2↑+6OH-
2Al-6e-+8OH-===2AlO2-+4H2O
(2)类型二 题目给出原电池的总反应式
若有一个电极反应式较难写出,可先写出较易写出的电极反应式,然后再用总反应式减去该电极反应式即得到另一电极反应式。
当氧化剂、还原剂、氧化产物、还原产物由多种元素组成时,还应考虑电解质是否参与了反应。
分析原电池总反应式中各元素的化合价变化情况,找出氧化剂及其对应的还原产物,氧化剂发生的反应即为正极反应;找出还原剂及其对应的氧化产物,还原剂发生的反应即为负极反应。
例3 根据下列原电池的总反应式,写出其电极反应式。(1)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备硫酸铜,若将该反应设计为原电池,其负极反应式是__________________________,正极反应式是_______________________。(2)某原电池总反应为2FeO42-+3H2===Fe2O3+4OH-+H2O,在该原电池中:负极反应式是______________________________;正极反应式是__________________________________。
2FeO42-+5H2O+6e-===Fe2O3+10OH-
2Cu-4e-===2Cu2+
O2+4e-+4H+===2H2O
3H2-6e-+6OH-===6H2O
1.比较金属活动性强弱
对于酸性电解质,一般是负极金属的活动性较强,正极金属的活动性较弱。
例4 把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( ) A.a > b > c > d B.a > c > d > b C.c > a > b > d D.b > d > c > a
2.加快氧化还原反应的速率
构成原电池的反应速率比直接接触的反应速率快。
例5 等质量的两份锌粉a、b中分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液,下列各图表示的是产生H2的体积V与时间t的关系(其他条件相同),其中正确的是( ) A B C D
将电池总反应拆成两个半反应,即原电池的负极反应和正极反应。
画出装置图,并注明电极材料和电解质溶液
确定负极材料、正极材料和电解质溶液。
设计原电池时电解质溶液和电极材料的选择
电池的电极材料必须能导电。①活动性不同的两种金属。如锌铜原电池,锌作负极,铜作正极。②金属和非金属。如锌作负极,石墨棒作正极。③金属和化合物。如铅蓄电池,铅块作负极,PbO2作正极。④惰性电极。如氢氧燃料电池中,两电极均可用Pt。
电解质溶液一般要能够与负极材料发生反应。若是两个半反应分别在两个烧杯中进行,则电解质溶液应作正极电解液。
例6 请用FeCl3溶液、CuCl2溶液、盐桥、铜片、石墨棒设计原电池实现电池反应:2FeCl3+Cu===2FeCl2+CuCl2
(负极):Cu-2e-===Cu2+(正极):2Fe3++2e-===2Fe2+
构成盐桥作用正负极判断
比较金属活动性强弱加快氧化还原反应的速率设计原电池
1、下列电极反应式书写正确的是( )A.铝、铜与浓硝酸组成的原电池,负极的电极反应式为Al-3e-===Al3+B.铜、锌在稀硫酸中构成原电池,正极的电极反应式为2H++2e-===H2↑C.以铜为电极将2Fe3++Cu===2Fe2++Cu2+设计成原电池,正极的电极反应式为Cu-2e-===Cu2+D.以铝、铁为电极,在氢氧化钠溶液中构成原电池,负极的电极反应式为Al-3e-===Al3+
2、某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2===2H2O。下列有关说法正确的是( )
A.电子通过外电路从b极流向a极B.b极上的电极反应为O2+2H2O+4e-===4OH-C.每转移0.1 ml电子,消耗1.12 L的H2D.H+由a极通过固体电解质移向b极
高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化集体备课ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009311_t3/?tag_id=26" target="_blank">第二单元 化学能与电能的转化集体备课ppt课件</a>,共1页。
高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第一节 原电池集体备课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002434_t3/?tag_id=26" target="_blank">第四章 化学反应与电能第一节 原电池集体备课课件ppt</a>,共23页。PPT课件主要包含了回顾旧知,工作原理,探索新知,演示实验1,锌片表面附着红色固体,电流逐渐衰减,ZnSO4,CuSO4,发生偏移,讨论与交流等内容,欢迎下载使用。
鲁科版 (2019)选择性必修1第2节 化学能转化为电能——电池说课课件ppt: 这是一份鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002574_t3/?tag_id=26" target="_blank">第2节 化学能转化为电能——电池说课课件ppt</a>,共22页。PPT课件主要包含了电解质溶液,原电池的工作原理,还原反应,氧化反应,原电池的形成条件,原电池的应用,设计原电池,原电池正负极的判断,活泼的金属,阳离子移向等内容,欢迎下载使用。













