




高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡评优课ppt课件
展开1.通过溶解和结晶过程的分析,认识化学反应的可逆性。2.通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡,理解并会判断化学平衡状态的标志。
1.可逆反应都有一定的限度,是可调控的,条件改变,限度被破坏, 达到新的平衡状态。能从多角度、动态地分析化学平衡状态的各种表现。培养学生“变化观念与平衡思想”的学科素养。2.能建立“逆、等、动、定、变”的认知模型,并利用模型解决化学平衡的实际问题,培养学生“证据推理与模型认知”的学科素养。
合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,原理如下:
为了提高生产效率,我们除了考虑提高化学反应速率问题,还应该考虑转化程度问题。
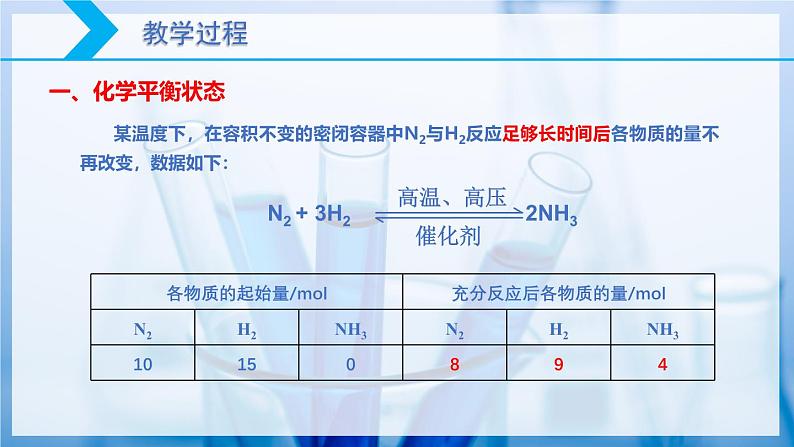
某温度下,在容积不变的密闭容器中N2与H2反应足够长时间后各物质的量不再改变,数据如下:
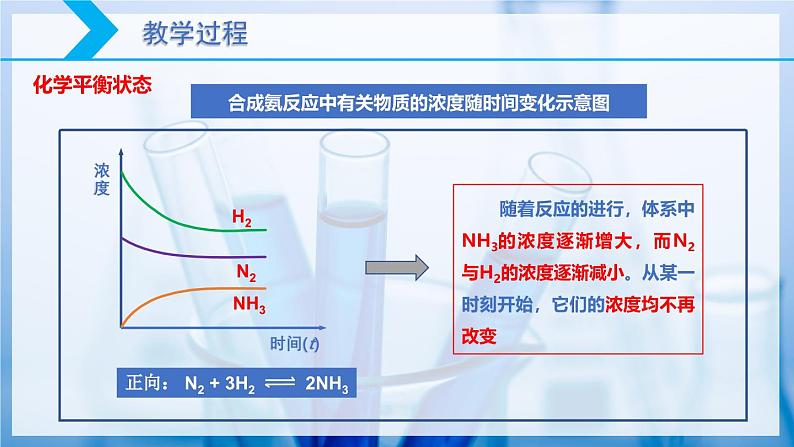
随着反应的进行,体系中NH3的浓度逐渐增大,而N2与H2的浓度逐渐减小。从某一时刻开始,它们的浓度均不再改变
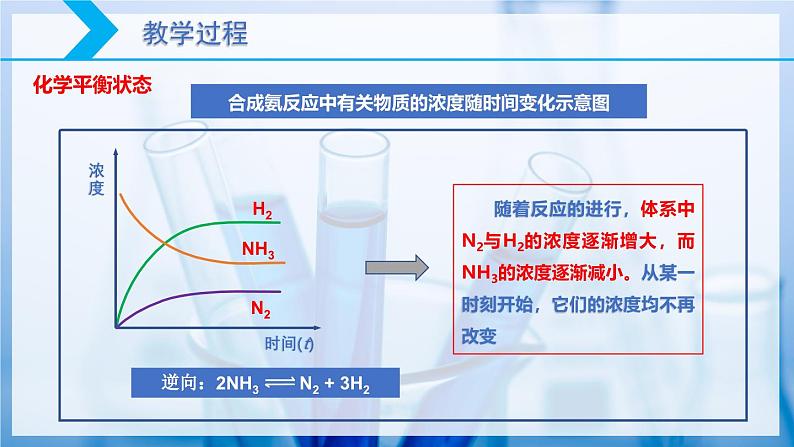
随着反应的进行,体系中N2与H2的浓度逐渐增大,而NH3的浓度逐渐减小。从某一时刻开始,它们的浓度均不再改变
2.转化率:化学反应的限度决定了反应物在一定条件下的最大转化率。
1. 定义: 在一定条件下,在可逆反应体系中,正反应速率与逆反应速率相等,反应物的浓度与生成物的浓度均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态我们称之为化学平衡状态,简称化学平衡。
化学平衡的特征:“逆”、“等”、“动”、“定”、“变”
化学平衡只存在于可逆反应中;
达到化学平衡状态时,v正=v逆≠0
化学平衡是一个动态平衡;
当条件变化时,原平衡被破坏,在新的条件下会重新建立新的平衡。
平衡时反应物和生成物的浓度保持不变
3.化学平衡状态的特征
你觉得这些特征中,哪些可以说明一个可逆反应达到了一定条件下的反应限度(化学平衡状态)?
如何理解 v(正)=v(逆)?
核心:1、有正有逆的描述;2、转化为同一物质速率相等
有正有逆 符合比例
核心:一个量随反应一直变,突然不变
例如,一定条件下,对于可逆反应N2+3H2 2NH3,表示正、逆反应速率可以用N2或H2或NH3来表示,下列能表示反应达到化学平衡状态的是 (1)容器内氮气的物质的量不再改变(2)容器内颜色不再改变(3)固定容器恒容条件下,容器内压强不再改变(4)固定容器恒容条件下,容器内气体密度不再改变 (5)恒容或恒压条件,容器内平均相对分子质量不再改变
(1) (3) (5)
下列说法中可以证明2HI(g) H2(g)+I2(g)(紫色)已达到平衡状态的是___________。 ①单位时间内生成 n ml H2的同时生成 n mlHI ②一个H-H键断裂的同时有两个H-I键断裂 ③ 反应速率 v(H2) = v(I2) 时 ④c(HI):c(H2):c(I2) = 2:1:1时 ⑤温度和体积一定,容器内压强不再变化时 ⑥温度和体积一定,混合气体的颜色不再变化时 ⑦条件一定,混合气体的平均相对分子质量不再变化时 ⑧温度和压强一定,混合气体的密度不再变化时
可逆反应2NO2(红棕色) N2O4(无色)在一固定密闭容器中反应,达到化学平衡状 态的是( )A.单位时间内生成n ml N2O4 同时生成2n ml NO2B.单位时间内生成n ml N2O4 同时消耗2n ml NO2C.c(NO2):c(N2O4)= 2: 1D.混合气体的颜色不再改变E.混合气体的密度不再改变F.混合气体的平均相对分子质量不再改变H.混合气体各组分的体积分数不再改变
在一定条件下,向2 L密闭容器中通入2 ml N2和6 ml H2,发生反应:N2(g)+3H2(g) 2NH3(g),以下选项能够说明反应已达到平衡状态的是( )
A.c(NH3)∶c(H2)∶c(N2)=2∶3∶1B.单位时间内1个 键断裂的同时,有6个N—H键形成C.混合气体的平均相对分子质量不再改变D.单位时间内有6个N—H键形成的同时,有3个H—H键断裂
化学人教版 (2019)第二节 化学平衡评优课ppt课件: 这是一份化学人教版 (2019)<a href="/hx/tb_c4002420_t3/?tag_id=26" target="_blank">第二节 化学平衡评优课ppt课件</a>,共25页。PPT课件主要包含了学习目标,教学过程等内容,欢迎下载使用。
化学选择性必修1第二节 化学平衡完整版ppt课件: 这是一份化学选择性必修1<a href="/hx/tb_c4002420_t3/?tag_id=26" target="_blank">第二节 化学平衡完整版ppt课件</a>,共20页。PPT课件主要包含了学习目标,素养目标,情境引入,化学平衡常数,教学过程,课堂练习,K22,K12K2,浓度熵等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 化学平衡优质课件ppt: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002420_t3/?tag_id=26" target="_blank">第二节 化学平衡优质课件ppt</a>,文件包含22化学平衡第3课时影响化学平衡的因素pptx、media1mp4、media2mp4、media3mp4等4份课件配套教学资源,其中PPT共27页, 欢迎下载使用。













