






高中化学人教版 (2019)选择性必修1第一节 化学反应速率公开课课件ppt
展开1.了解基元反应及反应历程。2.了解有效碰撞理论,并能用有效碰撞原理解释条件对化学反应速率的影响。3.知道活化能的含义及其对化学反应速率的影响。4.了解催化剂在生产、生活和科学研究领域中的重大作用。
1.通过理解微观分子对反应速率的影响,培养学生“宏观辨识与微观探析”的学科素养。2.通过有效碰撞理论,理解影响化学反应速率的因素,培养学生“证据推理与模型认知”的学科素养。
通过生活经验和之前所学知识,我们知道,不同化学反应速率不同,浓度、温度、压强、催化剂也会影响化学反应速率。这些从宏观上都已得到证实,从微观上我们怎么理解这些反应速率不同?
一、基元反应和反应历程
大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。每一步反应都称为基元反应。
第一步: 2HI → 2I• (自由基)+ H2 第二步: 2I• → I2
如:总反应:2HI =H2 + I2 实际上是经过下列两步反应完成的
这其中的每一步反应都称为基元反应。这两个先后进行的基元反应反映了2HI=H2+I2的反应历程。反应历程又称反应机理。
自由基:带有单电子的原子或原子团。自由基的反应活性很强。
2.反应历程(反应机理)
基元反应构成的反应序列称为反应历程,基元反应的总和称为总反应。
基元反应发生的先决条件是反应物的分子必须发生碰撞
1.反应不同,反应历程也不相同2.同一反应,在不同条件下,反应历程也可能不同3.反应历程的差别造成了化学反应速率的不同4.对于由多个基元反应组成的化学反应,其反应的快慢由最慢的一步基元反应决定
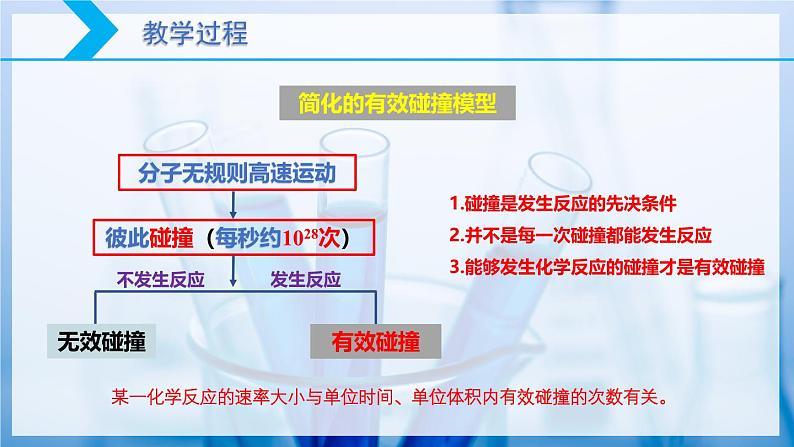
以气体为例,任何气体中分子间的碰撞次数都是非常巨大的。通常情况下,当气体的浓度为1 ml/L时,在每立方厘米、每秒内反应物分子间的碰撞可达到1028次。如果反应物分子间的任何一次碰撞都能发生反应的话,任何气体的反应均可以瞬间完成。但实际并非如此。这说明并不是反应物分子的每一次碰撞都能发生反应。
彼此碰撞(每秒约1028次)
1.碰撞是发生反应的先决条件2.并不是每一次碰撞都能发生反应3.能够发生化学反应的碰撞才是有效碰撞
某一化学反应的速率大小与单位时间、单位体积内有效碰撞的次数有关。
1.有效碰撞的概念:能发生化学反应的碰撞称为有效碰撞。
碰撞时取向不合适
HI分解反应中分子碰撞示意图
(1)分子具有足够的能量;(2)分子在碰撞时具有合适的取向。(3)有效碰撞与反应速率的关系:有效碰撞的频率越高,则反应速率越快。
2.有效碰撞必须满足的条件:
三、活化分子 活化能
1. 活化分子:具有足够能量、能够发生有效碰撞的分子。
活化分子的碰撞不一定是有效碰撞,还与碰撞的角度有关。(碰撞时的取向合适不合适)
反应速率与活化分子的百分率(活%)成正比
基元反应发生经历的过程
2. 活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。
反应物、生成物的能量与活化能的关系图
从上图可知:活化能与化学反应难易的关系是
活化能高,反应难;活化能低,反应易。
四、有效碰撞理论对影响化学反应速率因素的解释
结合碰撞理论,探讨外因的改变影响化学反应速率的原因:
1、浓度对反应速率的影响
反应物浓度增大,即单位体积内反应物分子总数增大
单位时间有效碰撞次数增多
单位体积内活化分子数增加
2、温度对反应速率的影响
单位体积内活化分子数和活化分子百分数增加
分子运动加快,碰撞频率增加
3、压强对反应速率的影响
4、催化剂对反应速率的影响
(1)催化剂参与化学反应,改变反应途径,但反应前后质量和化学性质不变的物质。
(2)催化剂作用:可以降低化学反应所需的活化能,也就等于提高了活化分子的百分数,从而提高了有效碰撞的频率,反应速率大幅提高。
已知反应2NO(g)+2H2(g) N2(g)+2H2O(g) ΔH=-752 kJ·ml-1的反应机理如下:①2NO(g) N2O2(g) (快)②N2O2(g)+H2(g) N2O(g)+H2O(g) (慢)③N2O(g)+H2(g) N2(g)+H2O(g) (快)下列有关说法错误的是( )A.①的逆反应速率大于②的正反应速率B.②中N2O2与H2的碰撞仅部分有效C.N2O2和N2O是该反应的催化剂D.总反应中逆反应的活化能比正反应的活化能大
【答案】C【解析】①为快反应,说明正反应的活化能和逆反应的活化能都较小,反应更容易发生;②为慢反应,说明正反应的活化能和逆反应的活化能都较大,②中正反应的活化能大于①中逆反应的活化能,因此①的逆反应速率大于②的正反应速率,A项正确;②为慢反应,反应慢说明反应的活化能大,物质微粒发生碰撞时,许多碰撞都不能发生化学反应,因此碰撞仅部分有效,B项正确;反应过程中N2O2和N2O是中间产物,不是催化剂,C项错误;总反应为放热反应,则总反应中逆反应的活化能比正反应的活化能大,D项正确。
我们把能够发生化学反应的碰撞叫做有效碰撞;发生有效碰撞的分子必须具有足够的能量,这种分子叫做活化分子;活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。下列说法不正确的是( ) A.图甲中曲线Ⅱ可以表示催化剂降低了反应的活化能 B.图乙中HI分子发生了有效碰撞 C.盐酸和氢氧化钠溶液的反应活化能接近于零 D.增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加
【答案】B【解析】催化剂可降低反应的活化能,A正确;能够发生化学反应的碰撞才是有效碰撞,由图乙可知碰撞后没有生成新物质,即没有发生化学反应,不是有效碰撞,B错误;盐酸和氢氧化钠溶液反应的实质是氢离子与氢氧根离子反应生成水,在溶液中氢离子与氢氧根离子已经处于活跃状态,因此盐酸和氢氧化钠溶液反应的活化能接近于零,C正确;增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加,D正确。
N2分子在催化剂的作用下发生的一系列转化如图所示。下列叙述正确的是( )A.在反应过程中作催化剂B.催化剂a表面发生了分解反应和化合反应C.催化剂a、b增大了该历程中的最大能垒(活化能)D.催化剂b表面发生的反应为4NH3+5O2 4NO+6H2O
某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程如图所示(图中只画出了HAP的部分结构,用18O标记羟基磷灰石中的羟基氧原子)。下列说法正确的是( ) A.反应物的键能之和大于生成物的键能之和 B.HAP改变了该反应的历程和焓变,加快了反应速率 C.经过该催化氧化过程后18O仍然在HAP中 D.HAP降低了反应的活化能,提高活化分子百分数
【答案】D【解析】根据甲醛的燃烧反应可知甲醛与氧气生成CO2和H2O的反应为放热反应,则反应物的键能之和小于生成物的键能之和,A项错误;催化剂能够改变反应的历程,但是不能改变反应的焓变,B项错误;从题图可知,反应结束后18O在H2O中,C项错误。
“接触法制硫酸”的主要反应是2SO2+O2 2SO3,在催化剂表面的反应历程如下:
下列说法正确的是( )A.使用催化剂只能加快正反应速率B.反应②的活化能比反应①大C.该反应的催化剂是V2O4D.过程中既有V—O的断裂,又有V—O的形成
【答案】D【解析】催化剂能同等幅度地改变正、逆反应速率,加快正反应速率的同时也加快逆反应速率,故A错误;一般情况下,反应的活化能越小,反应速率越快,故反应②的活化能比反应①的小,故B错误;催化剂是反应前后质量和化学性质都没有发生变化的物质,从反应历程图中可知,该反应的催化剂为V2O5,故C错误;历程中反应①有V—O的断裂,反应②有V—O的形成,故D正确。
Shyam Kattle等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,吸附在Pt/SiO2催化剂表面上的物种用“·”标注,Ts表示过渡态。下列有关说法错误的是( )
A.物质被吸附在催化剂表面形成过渡态的过程是吸热的B.形成过渡态Ts1的活化能为1.05 eVC.前三步总反应的ΔH<0D.反应历程中能量变化最大的反应方程式为·HOCO+7/2H2(g)=·CO+·OH+7/2H2(g)
【答案】D【解析】A项,从图示可看出形成过渡态物质的能量都是升高的,正确;B项,从图中能量差可知,过渡态Ts1的能量为0.15 eV,则该步的活化能为[0.15-(-0.9)] eV=1.05 eV,正确;D项,前三步中能量变化最大的是第二步,该步骤分两步形成稳定的微粒,反应方程式为·HOCO+(7/2)H2(g)=·CO+·OH+·H+3H2(g),错误。
【思维建模】活化分子、有效碰撞与反应速率的关系
人教版 (2019)选择性必修1第一节 化学反应速率获奖课件ppt: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002419_t3/?tag_id=26" target="_blank">第一节 化学反应速率获奖课件ppt</a>,共19页。PPT课件主要包含了学习目标,情境引入,教学过程,课堂练习等内容,欢迎下载使用。
高中人教版 (2019)第一节 化学反应速率一等奖ppt课件: 这是一份高中人教版 (2019)<a href="/hx/tb_c4002419_t3/?tag_id=26" target="_blank">第一节 化学反应速率一等奖ppt课件</a>,文件包含核心素养目标人教版2019高二化学选择性必修一21化学反应速率第2课时影响化学反应速率的因素pptx、media1mp4、media2mp4等3份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 化学反应速率授课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 化学反应速率授课课件ppt,共44页。PPT课件主要包含了定向爆破,火箭发射,平均值,不同物质浓度,化学计量数,固体或,纯液体,催化剂,其他因素,力量不够等内容,欢迎下载使用。














