






- 《化学反应速率》第二课时课件PPT+教学设计 课件 31 次下载
- 《化学反应速率》第三课时课件PPT+教学设计 课件 27 次下载
- 《化学平衡》第二课时课件PPT+教学设计 课件 24 次下载
- 《化学平衡》第三课时课件PPT+教学设计 课件 24 次下载
- 《化学平衡》第四课时课件PPT+教学设计 课件 26 次下载
高中人教版 (2019)第二节 化学平衡精品教学课件ppt
展开1.掌握可逆反应的定义、表示方法、常见的可逆反应。2.掌握化学平衡状态建立的过程。3.掌握化学平衡状态的定义,特征和标志。重点:化学平衡状态建立的过程,化学平衡状态的定义,特征和标志。难点:化学平衡状态的标志。
自1784年氨被发现以来,人们一直在研究如何利用化学方法由氮气和氢气合成氨,直到1913年才实现了合成氨的工业化生产。化学反应N2(g)+3H2(g) ⇌2NH3(g)看起来十分简单,合成氨的工业化生产却经历了漫长的发展过程。化工生产中,我们需要考虑哪些因素呢?
——化学反应进行的限度
使原料尽可能快地转化为产品
使原料尽可能多地转化为产品
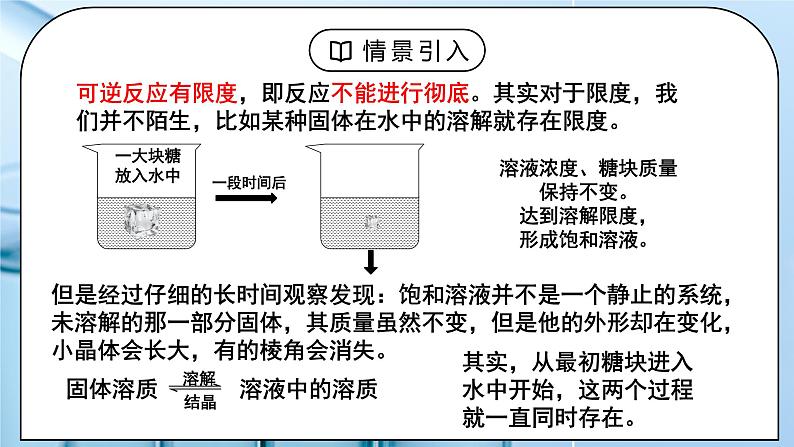
可逆反应有限度,即反应不能进行彻底。其实对于限度,我们并不陌生,比如某种固体在水中的溶解就存在限度。
溶液浓度、糖块质量保持不变。达到溶解限度,形成饱和溶液。
但是经过仔细的长时间观察发现:饱和溶液并不是一个静止的系统,未溶解的那一部分固体,其质量虽然不变,但是他的外形却在变化,小晶体会长大,有的棱角会消失。
固体溶质 溶液中的溶质
其实,从最初糖块进入水中开始,这两个过程就一直同时存在。
1.定义:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
双向性:可逆反应分为正反应方向和逆反应方向
双同性:正、逆反应在同一条件下同时进行
共存性:反应物与生成物共存,反应物的转化率小于100%
练习1、下列反应属于可逆反应的是 ( )A.Na溶于水的反应B.NH3溶于水的反应C.可充电电池的反应,如H2O+Zn+Ag2O Zn(OH)2+2AgD.电解水生成H2和O2,点燃H2和O2的混合物生成水
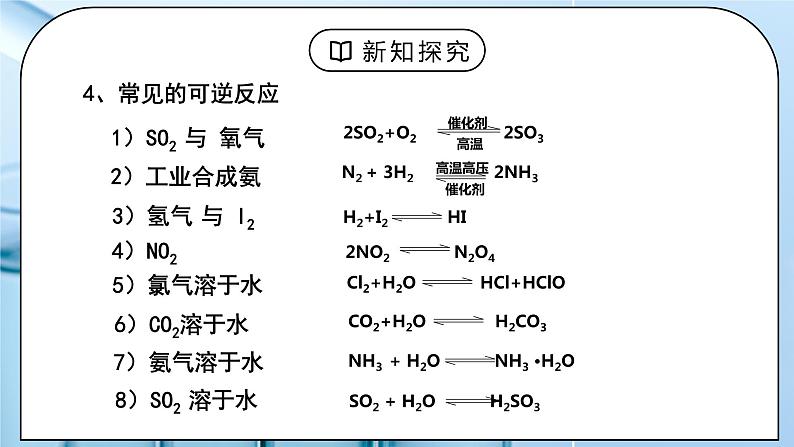
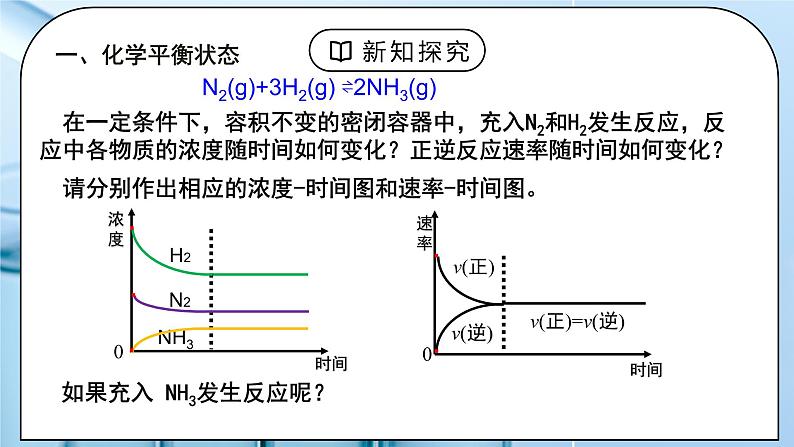
N2(g)+3H2(g) ⇌2NH3(g)
如果充入 NH3发生反应呢?
在一定条件下,容积不变的密闭容器中,充入N2和H2发生反应,反应中各物质的浓度随时间如何变化?正逆反应速率随时间如何变化?
请分别作出相应的浓度-时间图和速率-时间图。
一定条件下的可逆反应,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
平衡状态是在一定条件下,可逆反应所能进行的最大程度,即可逆反应的限度。
化学平衡状态的研究对象是_______反应
各组分浓度/物质的量/百分含量________
v正 ____ v逆 ____ 0,是一个动态平衡
外界条件改变时,原平衡状态被破坏,在新条件下建立平衡
2.化学平衡状态的特征:
如何判断一个化学反应是否已达到平衡状态呢?
①同一物质:生成速率=消耗速率,即v正(A)=v逆(A)②不同物质:速率之比=化学计量数之比,但必须是不同方向的速率
速率必须一个是正反应速率,一个是逆反应速率,且经过换算后同一物质的消耗速率和生成速率相等
标志一 :v正=v逆≠0
直接依据——根据速率关系
因为任何时刻速率比都等于系数比
2.反应后c(H2):c(N2):c(NH3) = 3:1:2
以下可否判断反应达平衡?
A、3v正(N2)=v正(H2) B、v正(N2)=v逆(NH3)C、2v正(H2)=3v逆(NH3) D、v正(N2)=3v逆(H2)
练习2、下列各反应物或生成物速率可以证明反应N2+3H2 2NH3 已达平衡状态的是:( )
练习3、可逆反应:N2+3H2 2NH3 ,在恒容的密闭容器中进行,下列能证明达到平衡状态的标志有:( )①单位时间内生成2n ml NH3的同时生成3n ml H2②单位时间内生成n ml N2的同时生成3n mlH2③用N2、H2、NH3表示的反应速率的比为1∶3∶2的状态④1 ml N≡N断裂的同时,有6 ml N—H形成⑤N2、H2、NH3的浓度比为1∶3∶2的状态
直接依据——各组成成分的含量保持不变
各组分浓度 c 不再改变
各组分物质的量 n 不再改变
各组分质量 m 不再改变
各组分百分含量不再改变,如质量分数 w 、体积分数
(注意不是相等,也不是成一定的比值)
注意:绝大多数情况下,体积分数不变,可以作为判断平衡的依 据,个别情况例外
从反应开始起,B、C的体积分数均为1/2,始终没有改变,不是变量,不能作为判断平衡状态的依据。
(2)组分含量不再改变
各组分的m 、n 或 浓度不再变化
各物质的百分含量不变(物质的量分数、质量分数、转化率、产率等)
同一物质:生成速率=消耗速率,即v正(A)=v逆(A)不同物质:速率之比=化学计量数之比,但必须是不同方向的速率
(1)正反应速率等于逆反应速率
对于纯气体参加的可逆反应
①m+n≠p+q时,总压强一定 (其他条件一定)
②m+n = p+q时,总压强一定 (其他条件一定)
压强P \ 平均摩尔质量M \ 密度ρ\ 温度T \颜色
反应体系内有色物质的颜色一定
恒温恒压时,m+n≠p+q,则密度一定时
练习4、在一密闭容器中进行如下反应:2SO2(g)+O2(g) 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 ml/L、0.1 ml/L、0.2 ml/L,当反应达平衡时,可能存在的数据是( )A.SO2为0.4 ml/L、O2为0.2 ml/LB.SO2、SO3均为0.15 ml/LC.SO3为0.25 ml/LD.SO3为0.4 ml/L
练习5、在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(s)+3B(g)⇌2C(g)+D(g)已达平衡状态的是(其中只有B气体有颜色)( ) A.混合气体的压强B.混合气体的密度C.气体的平均分子量 D.气体的颜色
练习6、在一定温度下,下列叙述不是可逆反A(g)+3B(g)⇌2C(g)+2D(s)达到平衡的标志的是( )①C的生成 速率与C的分解速率相等 ②单位时间内生成amlA,同时生成3amlB ③A、B、C的浓度不再变化④A、B、C的百分含量不再变化⑤混合气体的总压强不再变化⑥混合气体的物质的量不再变化⑦单位时间内消耗amlA,同时生成 3amlB⑧A、B、C、D的分子数之比为1:3:2:2A.②⑧ B.②⑤⑧ C.①③④⑦ D.②⑤⑥⑧
练习7、在两个恒容的密闭容器中进行下列两个可逆反应: 甲:C(s)+H2O(g) ⇌ CO(g)+H2(g) 乙:CO(g)+H2O(g) ⇌ CO2(g)+H2(g) 现有下列状态:①混合气体平均相对分子质量不再改变 ②恒温时,气体压强不再改变 ③各气体组成浓度相等 ④体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水质量与生成氢气质量比为9:1 其中能表明甲、乙容器中反应都达到平衡状态的是( )A.①②⑤ B.③④⑥ C.⑥⑦ D.④⑤
人教版 (2019)选择性必修1第二节 化学平衡教学课件ppt: 这是一份人教版 (2019)选择性必修1第二节 化学平衡教学课件ppt,文件包含《化学平衡》第五课时课件pptx、《化学平衡》第五课时教学设计docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡一等奖教学ppt课件: 这是一份人教版 (2019)选择性必修1第二节 化学平衡一等奖教学ppt课件,文件包含《化学平衡》第四课时课件pptx、《化学平衡》第四课时教学设计docx等2份课件配套教学资源,其中PPT共26页, 欢迎下载使用。
人教版 (2019)第一节 电离平衡评优课教学ppt课件: 这是一份人教版 (2019)第一节 电离平衡评优课教学ppt课件,文件包含《电离平衡》第一课时课件pptx、《电离平衡》第一课时教学设计docx等2份课件配套教学资源,其中PPT共21页, 欢迎下载使用。














