








- 《化学平衡》第一课时课件PPT+教学设计 课件 30 次下载
- 《化学平衡》第二课时课件PPT+教学设计 课件 24 次下载
- 《化学平衡》第四课时课件PPT+教学设计 课件 26 次下载
- 《化学反应进行的方向》课件PPT+教学设计 课件 29 次下载
- 《化学反应的调控》课件PPT+教学设计 课件 23 次下载
高中人教版 (2019)第二节 化学平衡精品教学课件ppt
展开1.通过实验探究,理解温度、浓度、压强和催化剂对化学平衡状态的影响。2.学会用图示的方法表示在可逆反应中正逆反应速率随外界条件的变化,并分析平衡移动的方向。3.理解勒夏特列原理,会用勒夏特列原理分析化学平衡移动的方向。重点:通过实验探究,理解温度、浓度、压强和催化剂对化学平衡状态的影响,会画速率时间图。难点:理解勒夏特列原理,会用勒夏特列原理分析化学平衡移动的方向。
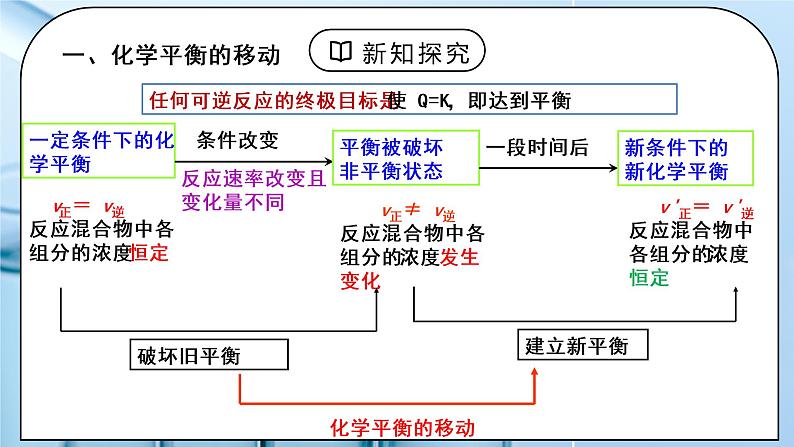
化学平衡状态的定义:(化学反应的限度)一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
化学平衡的特征:逆等动定变
——可逆反应(或可逆过程)——V正 =V逆(用同一物质浓度表示)——动态平衡。 (V正=V逆≠0)——平衡时,各组分浓度、含量保持不变(恒定)——条件改变,平衡发生改变
反应速率改变且变化量不同
平衡被破坏 非平衡状态
v正= v逆反应混合物中各组分的浓度恒定
v正≠ v逆反应混合物中各组分的浓度发生变化
v'正= v'逆反应混合物中各组分的浓度恒定
任何可逆反应的终极目标是使 Q=K,即达到平衡
V正>V逆 平衡正向移动
V正、V逆都发生了变化,但变化程度相同,平衡不移动
V正
2、本质:当外界某一条件改变时,造成V正≠V逆,可逆反应将在新的条件下达到新的平衡。
(1)速率判断:条件改变
有哪些条件能改变化学平衡呢?
Q<K,反应向正方向进行
Q = K,反应达到平衡状态
Q >K,反应向逆方向进行
(2)浓度商判断:对于一般的可逆反应:mA(g)+nB(g) ⇌ pC(g)+qD(g)
可通过改变影响反应速率的条件来打破原有平衡,建立新平衡。
【回忆】影响化学反应速率的外界条件主要有哪些?
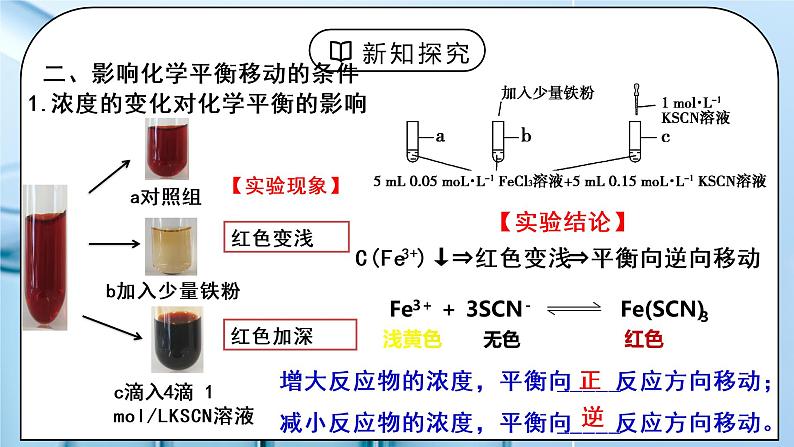
c滴入4滴 1 ml/LKSCN 溶液
增大反应物的浓度,平衡向_____反应方向移动;减小反应物的浓度,平衡向_____反应方向移动。
二、影响化学平衡移动的条件
1.浓度的变化对化学平衡的影响
C(Fe3+)↓⇒红色变浅⇒平衡向逆向移动
浅黄色 无色 红色
Fe+2Fe3+ = 3Fe2+
加入铁粉,Fe3+浓度减小,
Q 增大 ,Q>K,平衡逆向移动
加入KSCN,SCN-浓度增大,
Q 减小 ,Q<K,平衡正向移动
改变反应物浓度瞬间,只能改变正反应速率 改变生成物浓度瞬间,只能改变逆反应速率
改变浓度瞬间, 若v(正)>v(逆),平衡向正反应方向移动 若v(逆)>v(正),平衡向逆反应方向移动
②反应物有两种或两种以上时,增加一种反应物的浓度,该物质平衡转化率下降,其他物质转化率提高,工业上增大成本较低的反应物的浓度,提高成本较高的原料的转化率。
注意:①固体和纯液体的浓度是常数,改变其量不会影响反应速率,化学平衡不移动
③新旧平衡速率比较: 增大反应物(生成物)浓度,无论平衡移动方向如何新平衡速率大于旧平衡速率 减小浓度,新平衡速率小于旧平衡速率
规律:在其他条件不变的情况下,反应物浓度减小或者生成物浓度增加,化学平衡向逆反应方向移动;反应物浓度增加或者生成物浓度减小,化学平衡向正反应方向移动。
例:可逆反应H2O(g) + C(s) CO(g) + H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?
①增大水蒸气浓度 ②加入更多的碳 ③增加H2浓度
①平衡正向移动,CO浓度增大
②平衡不移动,CO浓度不变
③平衡逆向移动,CO浓度减小
小结:增加固体或纯液体的量不能改变其浓度,也不能改变速率,所以ν正仍等于ν逆,平衡不移动。
红棕色 无色
(1)压强增大:气体颜色先变深,后变浅。(2)压强减少:气体颜色先变浅,后变深。
2.压强的变化对化学平衡的影响
当加压气体体积缩小时,混和气体颜色先变深是由于NO2浓度增大 ,后又逐渐变浅是由于 平衡向正反应方向移动; 当减压气体体积增大时,混和气体颜色先变浅是由于①NO2浓度减小, 后又逐渐变深是由于平衡向逆反应方向移动。
[讨论] 对于反应2NO2(气) N2O4(气)试比较以下三种状态下的压强关系: 改变压强前混和气体压强P1;改变压强后瞬时气体压强P2;改变压强达新平衡后混和气体压强P3;加压:减压:
P2 > P3 > P1
P1 > P3 > P2
在其它条件不变的情况下: 增大压强,会使化学平衡向着气体体积缩小的方向移动; 减小压强,会使化学平衡向着气体体积增大的方向移动。
注意:①对于反应前后气体总体积相等的反应,改变压强对平衡无影响;
②平衡混合物都是固体或液体无气体的,改变压强不能使平衡移动;压强的变化必须改变混合物浓度才能使平衡移动。
③稀有气体对平衡的影响:
原平衡体系 体系总压强增大 体系中各反应成分的浓度不变 平衡不移动。
在已达平衡的气体可逆反应中,若加入与任何气体都不反应的稀有气体(即惰性气体),平衡是否移动有两种可能:
原平衡体系 容器容积增大、各反应气体的分压减小 体系中各组分的浓度同倍减小
例:下列反应达到化学平衡时,增大压强,平衡是否移动?向哪个方向移动?
① 2NO(g) + O2(g) 2NO2(g)② H2O(g) + CO(g) CO2(g) + H2(g)
③ H2O(g) + C(s) CO(g) + H2(g)④ CaCO3(s) CaO(s) + CO2(g)⑤ H2S(g) H2(g) + S(s)
2NO2(g) ⇌ N2O4(g) ΔH=-56.9 kJ·ml-1
红棕色 无色
其他条件不变时,升高温度,化学平衡向______反应方向移动; 降低温度,化学平衡向______反应方向移动。
3、温度对化学平衡的影响
混和物受热,速率均增大,但ν(吸)>ν(放) ,故平衡向吸热反应方向移动; 混和物遇冷,速率均减少,但ν(吸)<ν(放) ,故平衡向放热反应方向移动;
规律:其他条件不变时,升高温度,平衡向吸热的方向移动,降低温度,平衡向放热的方向移动
[讨论] 对于反应2NO2(气) N2O4(气)△H=-56.9kJ/ml试比较以下三种状态下的温度关系: 改变温度前混和气体温度T1;改变温度后瞬时气体温度T2;改变温度达新平衡后混和气体温度T3; 升温: 降温:
T1 >T3 > T2
4、催化剂对化学平衡的影响
规律: 催化剂同等程度改变化学反应速率, ν′正=ν′逆,只改变反应到达平衡所需要的时间,而不影响化学平衡的移动。
三、勒夏特列原理:1、内容:如果改变影响平衡的一个条件(如浓度、压强、温度)平衡就向能够减弱这种改变的方向移动。 2、注意: ①适用对象:所有的动态平衡(溶解平衡、化学平衡、电离平衡、水解平衡)都适用 ②从定性角度看,平衡移动的方向为减弱外界条件变化的方向 ③从定量的角度看,平衡移动的结果只能减弱(不可能抵消)外界条件的变化。
练习1、对任何一个平衡体系,采取下列措施一定引起平衡移动的是( )
练习2、某一温度下,在一带有活塞的体积可变的密闭容器中,可逆反应:N2+3H2 2NH3达到平衡,若向活塞施加一定的压力,使容器体积减小,则下列叙述正确的是( ) ;若保持该容器的体积不变,向该平衡体系中充入氩气,则下列叙述正确的是( )
A. ν正增大、 ν逆减少
B. ν正、 ν逆均不变
E. ν正、 ν逆均增大
练习3、 一定量的混合气体在密闭容器中发生反应: m A (g) + n B (g) p C (g)
达到平衡后,温度不变,将气体体积缩小到原来的1/2,但达到平衡时,C的浓度为原来的1.8倍,则下列说法正确的是( )
A、m + n > p
C、平衡向正反应方向移动
练习4、在高温下,反应(正反应为吸热反应)要使混合气体颜色加深,可采取的方法是( )
2HBr(g) H2(g) + Br2(g)
练习5、对某一可逆反应来说,使用催化剂的作用是( )A. 提高反应物的平衡转化率B. 以同样程度改变正逆反应的速率C. 增大正反应速率,降低逆反应速率D. 改变平衡混合物的组成
练习6、已知在氨水中存在下列平衡:
NH3 + H2O
NH4+ + OH-
(1)、向氨水中加入MgCl2固体,平衡向 移动, OH-浓度 ,NH4+浓度 。
(2)、向氨水中加入浓盐酸,平衡向 移动, 此时溶液中浓度减小的粒子有 。
OH-、NH3·H2O、NH3
(3)、向氨水中加入少量NaOH固体,平衡向 移动,此时发生的现象是 。
影响化学平衡的条件小结
高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学课件ppt,文件包含《盐类的水解》第三课时课件pptx、《盐类的水解》第三课时教学设计docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡教学课件ppt: 这是一份人教版 (2019)选择性必修1第二节 化学平衡教学课件ppt,文件包含《化学平衡》第五课时课件pptx、《化学平衡》第五课时教学设计docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡一等奖教学ppt课件: 这是一份人教版 (2019)选择性必修1第二节 化学平衡一等奖教学ppt课件,文件包含《化学平衡》第四课时课件pptx、《化学平衡》第四课时教学设计docx等2份课件配套教学资源,其中PPT共26页, 欢迎下载使用。














